
Isoamylacetatstruktur, egenskaper, syntes och användningar
De isoamylacetat är en ester vars molekylformel är CH3COO (CHtvå)tvåCH (CH3)två. Vid rumstemperatur består den av en oljig, klar, färglös, brandfarlig och flyktig vätska. Faktum är att den är för flyktig och doftande ester.
Dess huvudsakliga kännetecken är att ge bort en lukt som bidrar till doften av många frukter, särskilt de av banan. På samma sätt utgör denna sista frukt en av dess naturliga källor..

Därav namnet på bananolja som ges till en lösning av isoamylacetat eller till en blandning av isomylacetat med nitrocellulosa. Föreningen används ofta som smakämnen för mat, glass och godis.
Dessutom används den vid framställning av dofter med olika användningsområden. Det är också ett lösningsmedel som används vid extraktion av metaller och organiska föreningar såsom ättiksyra..
Isoamylacetat är resultatet av förestring av isoamylalkohol med ättiksyra. I organiska kemilärarlaboratorier representerar denna syntes en intressant upplevelse att genomföra förestring, samtidigt som laboratoriet översvämmas med banandoft.
Artikelindex
- 1 Struktur av isoamylacetat
- 1.1 Intermolekylära interaktioner
- 1.2 Banan doft
- 2 fastigheter
- 2.1 Kemiska namn
- 2.2 Molekylformel
- 2.3 Molekylvikt
- 2.4 Fysisk beskrivning
- 2,5 Lukt
- 2.6 Smak
- 2.7 Kokpunkt
- 2.8 Smältpunkt
- 2.9 Flampunkt
- 2.10 Löslighet i vatten
- 2.11 Löslighet i organiska lösningsmedel
- 2.12 Densitet
- 2.13 Ångdensitet
- 2.14 Ångtryck
- 2.15 Självantändningstemperatur
- 2.16 Viskositet
- 2.17 Förbränningsvärme
- 2.18 Lukttröskel
- 2.19 Brytningsindex
- 2.20 Relativ avdunstningshastighet
- 2.21 Dielektrisk konstant
- 2.22 Förvaring
- 3 Syntes
- 4 användningsområden
- 4.1 Smaksättning av mat och dryck
- 4.2 Lösningsmedel och utspädningsmedel
- 4.3 Dofter
- 4.4 Andra
- 5 risker
- 6 Referenser
Struktur av isoamylacetat
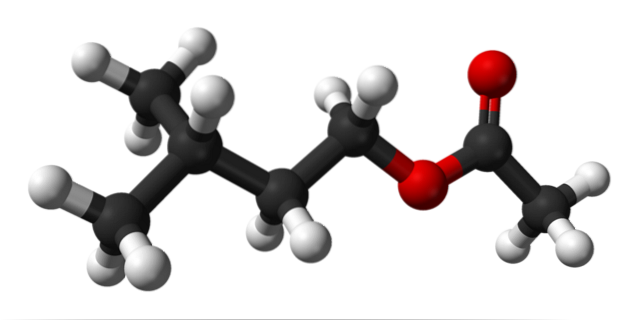
Den övre bilden visar den molekylära strukturen av isoamylacetat med hjälp av en sfär- och stapelmodell. De röda sfärerna motsvarar syreatomer, speciellt de som identifierar denna förening som en ester; dess eterdel, R-O-R och karbonylgruppen, C = O, sedan med strukturformeln R''COOR.
Till vänster, R'', vi har isopentylalkylradikalen, (CH3)tvåCHCHtvåCHtvå; och till höger, R, till metylgruppen, till vilken "acetatet" med namnet på denna ester är skyldig. Det är en relativt liten ester som kan interagera med de kemiska luktreceptorerna i våra näsor, vilket orsakar signaler som hjärnan tolkar som doft.
Intermolekylära interaktioner
Själva isoamylacetatmolekylen är flexibel; men isopentylradikalen gynnar inte intermolekylära interaktioner eftersom den är grenad, vilket steriskt förhindrar syreatomer från att interagera effektivt genom dipol-dipolkrafter.
Dessa två syre kan inte heller acceptera vätebindningar; strukturellt har molekylen inget sätt att donera dem. Till skillnad från de avbrutna dipolerna kan isoamylacetat interagera intermolekylärt med hjälp av Londons dispersionskrafter; som är direkt proportionella mot deras molekylära massa.
Således är det estermolekylmassan som är ansvarig för att dess molekyler bildar en vätska med hög kokpunkt (141 ° C). På samma sätt är den ansvarig för dess fasta smältning vid en temperatur av -78 ° C.
Banan doft
Dess intermolekylära krafter är så svaga att vätskan är tillräckligt flyktig för att genomsyra omgivningen med bananlukt. Intressant kan den söta lukten av denna ester förändras om antalet kol minskas eller ökas..
Det vill säga, om det i stället för att ha sex alifatiska kol hade fem (med isobutylradikalen) skulle dess lukt likna hallon; om radikalen var secbutyl, skulle lukten laddas med spår av organiska lösningsmedel; och om det hade mer än sex kol, började lukten bli tvål och metallisk.
Egenskaper
Kemiska namn
-Isoamylacetat
-Isopentyletanoat
-3-metylbutylacetat
-Isopentylacetat
-Banan- eller plantainolja.
Molekylär formel
C7H14ELLERtvå eller CH3COO (CHtvå)tvåCH (CH3)två
Molekylvikt
130,187 g / mol.
Fysisk beskrivning
Det är en oljig, klar och färglös vätska.
Odör
Vid rumstemperatur har den en intensiv och behaglig banallukt.
Smak
Den har en smak som liknar päron och äpple.
Kokpunkt
124,5 ºC.
Smältpunkt
-78,5 ºC.
antändningspunkt
Stängd kopp 33ºC; öppen kopp 38ºC (100ºF).
Vattenlöslighet
2000 mg / L vid 25 ºC.
Löslighet i organiska lösningsmedel
Blandbar med alkohol, eter, etylacetat och amylalkohol.
Densitet
0,876 g / cm3.
Ång-densitet
4,49 (relativt luft = 1).
Ångtryck
5,6 mmHg vid 25 ºC.
Självantändningstemperatur
360 ºF (680 ºF).
Viskositet
-1,03 cPoise vid 8,97 ° C
-0,872 cPoise vid 19,91 ° C.
Förbränningsvärme
8000 cal / g.
Lukttröskel
Luft = 0,025 µL / L
Vatten = 0,017 mg / L.
Brytningsindex
1400 vid 20 ºC.
Relativ avdunstningshastighet
0,42 (relativt butylacetat = 1).
Dialektrisk konstant
4,72 vid 20 ºC.
Lagring
Isoamylacetat är en flyktig och brandfarlig förening. Därför bör den förvaras kallt i helt lufttäta behållare, borta från brännbara ämnen..
Syntes
Det produceras genom förestring av isoamylalkohol med isättika, i en process som kallas Fishers förestring. Svavelsyra används ofta som en katalysator, men p-toluensulfonsyra katalyserar också reaktionen:
(CH3)tvåCH-CHtvå-CHtvåCHtvåOH + CH3COOH => CH3COOCHtvå-CHtvå-CHtvå-CH (CH3)två
Applikationer
Mat och dryck
Det används för att ge en päronsmak i vatten och sirap. Det används i Kina för att förbereda fruktsmaker, som jordgubbar, björnbär, ananas, päron, äpple, druva och banan. De använda doserna är: 190 mg / kg i konfektyr; 120 mg / kg i bakverk; 56 mg / kg i glass; och 28 mg / kg i läskedrycker.
Lösningsmedel och tunnare
Det är ett lösningsmedel för:
-Nitrocellulosa och celluloid
-Vattentäta lacker
-Ester tuggummi
-Vinylharts
-Coumarone harts och ricinolja.
Det används som lösningsmedel för bestämning av krom och används som extraktionsmedel för järn, kobolt och nickel. Det används också som lösningsmedel för oljefärger och gamla lacker. Dessutom används den vid tillverkning av nagellack.
Denna ester används som ett utspädningsmedel vid produktion av ättiksyra. Petroleum används som råvara i en oxidationsprocess som producerar en vattenlösning av ättiksyra och andra föreningar, såsom myrsyra och propionsyra..
Som ett lösningsmedel och bärare för andra ämnen användes det under de första dagarna av flygindustrin för att skydda tygerna till flygplanets vingar..
Dofter
-Det används som luftfräschare för att täcka dålig lukt.
-Den används som en parfym i skorns lack.
-För att testa effektiviteten hos gasmasker, eftersom isoamylacetat har en mycket låg luktgräns och inte är mycket giftig.
-Den används vid produktion av dofter som Cypern; den mjukt doftande osmanthusen; hyacinten; och den starka orientaliska smaken, som används i låga doser, mindre än 1%.
Andra
Den används vid tillverkning av siden och konstgjorda pärlor, fotografiska filmer, vattentäta lacker och bronzer. Det används också i textilindustrin vid färgning och efterbehandling. Det används vid kemtvätt av klädesartiklar och tygmöbler.
Dessutom används isoamylacetat vid framställningen av rayon, ett syntetiskt tyg; vid extraktion av penicillin, och som ett standardämne i kromatografi.
Risker
Isoamylacetat kan irritera huden och ögonen vid fysisk kontakt. Inandning kan orsaka irritation i näsa, hals och lungor. Under tiden kan exponering för höga koncentrationer orsaka huvudvärk, sömnighet, yrsel, yrsel, trötthet och svimning..
Långvarig hudkontakt kan göra att den blir torr och sprucken..
Referenser
- Bilbrey Jenna. (30 juli 2014). Isoamylacetat. Chemistry World av Royal Society of Chemistry. Återställd från: chemistryworld.com
- Nationellt centrum för bioteknikinformation. (2019). Isoamylacetat. PubChem-databas. Återställd från: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Isoamylacetat. Återställd från: en.wikipedia.org
- Royal Society of Chemistry. (2015). Isoamylacetat. Chemspider. Återställd från: chemspider.com
- New Jersey Department of Health and Senior Services. (2005). Isoamylacetat. [PDF]. Återställd från: nj.gov
- Kemikaliebok. (2017). Isoamylacetat. Återställd från: chemicalbook.com



Ingen har kommenterat den här artikeln än.