
Kaliumacetatstruktur, egenskaper, användningsområden, produktion
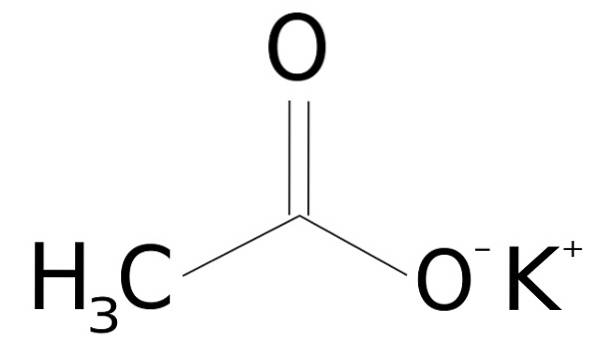
De kaliumacetat är en organisk förening bildad av en kalium K-jon+ och en acetatjon CH3KUTTRA-. Dess kemiska formel är CH3COOK eller KCH3COO, eller också CtvåH3KOtvå. Det är ett färglöst eller vitt kristallint fast ämne, mycket lösligt i vatten..
Det används för att reglera surheten hos vissa industriellt bearbetade livsmedel. På grund av dess stora affinitet med vatten används den i laboratorier eller i vissa processer för att absorbera vatten från andra föreningar, såsom att dehydrera alkohol..

Kaliumacetat deltar i vissa kemiska reaktioner som en accelerator för dessa och i syntesen av organiska föreningar. Det gör det också möjligt att öka bildandet av antikroppar (naturliga ämnen som bekämpar infektioner) i industriella metoder för att producera dem..
Dess mycket låga temperaturegenskaper gör den till en bra kandidat för användning i issmältande blandningar på betongvägar i mycket kalla klimat. Enligt konsulterade källor används den också i brandbekämpningsutrustning och i sammansättningar för att observera celler i mikroskop..
Artikelindex
- 1 Struktur
- 2 Nomenklatur
- 3 fastigheter
- 3.1 Fysiskt tillstånd
- 3.2 Molekylvikt
- 3.3 Smältpunkt
- 3.4 Densitet
- 3.5 Löslighet
- 3,6 pH
- 3.7 Övriga egenskaper
- 3.8 Uppförande vid uppvärmning
- 4 Skaffa
- 5 användningsområden
- 5.1 I olika applikationer
- 5.2 Inom polymerindustrin
- 5.3 I vetenskapliga och medicinska forskningslaboratorier
- 5.4 Vid industriell produktion av antikroppar
- 5.5 I frostskyddsblandningar
- 5.6 Hur det fungerar som frostskyddsmedel
- 6 Referenser
Strukturera
Kaliumacetat består av en kalium K-katjon+ och en acetatanjon CH3KUTTRA-. Den senare är den konjugerade basen av ättiksyra CH3COOH. Acetatjonen CH3KUTTRA- består av en metyl-CH3 fäst vid ett karboxylat -COO-.
Föreningen mellan båda jonerna är elektrostatisk eller jonisk, det vill säga föreningen mellan en positiv och en negativ jon.
Nomenklatur
- Kaliumacetat
- Kaliumetanoat
- Kaliumsalt av ättiksyra
- AcOK
- KOAc
Egenskaper
Fysiskt tillstånd
Färglös eller vit kristallin fast substans.
Molekylvikt
98,14 g / mol
Smältpunkt
292 ºC
Densitet
1,6 g / cm3
Löslighet
Mycket löslig i vatten: 256 g / 100 ml vid 20 ° C.
pH
En 5% vattenlösning av kaliumacetat har ett pH av 7,5-9,0.
Andra egenskaper
Ibland har det en svag ättika lukt. I en 10% lösning angriper den inte aluminium vid rumstemperatur men vid 60-70 ° C blir metallen mörkare och lider av grop.
Vid koncentrationer på 20% eller mer sker ytangrepp på aluminium vid vilken temperatur som helst.
Kaliumacetat (AcOK) är mycket lösligt i vatten. Den har ett hydrat: KCH3COO.1,5HtvåEller vilket är det fasta ämnet som erhålls genom kristallisering av det ur de vattenhaltiga lösningarna av AcOK.
Beteende vid uppvärmning
Om det hydratiserade kaliumacetatet (AcOK) (KCH3COO.1,5HtvåO) när den når 40 ° C börjar den förlora hydratiseringsvattnet.
KCH3COO.1,5HtvåO → KCH3COO + 1,5HtvåEller ↑
Om vattenfritt kaliumacetat värms upp (utan vatten: KCH3COO), när den når 340 ° C börjar den sönderdelas och bildar kaliumkarbonat KtvåCO3 enligt följande reaktion:
2 KCH3COO + 4 Otvå → KtvåCO3 + 3 HtvåO + 3 COtvå↑
Erhållande
Det kan framställas genom inverkan av kaliumhydroxid KOH på olika föreningar, såsom ättiksyra CH3COOH, ättiksyraanhydrid (CH3CO)tvåO och ammoniumacetat CH3COONH4.
KOH + CH3COOH → CH3COOK + HtvåELLER
Det kan också erhållas genom att reagera kaliumkarbonat KtvåCO3 eller KHCO kaliumbikarbonat3 med ättiksyra CH3COOH.
KHCO3 + CH3COOH → CH3COOK + HtvåO + COtvå↑
Kaliumacetat kan kristalliseras från vattenlösning för att erhålla hög renhet.
Applikationer
I olika applikationer
Kaliumacetat används i den bearbetade livsmedelsindustrin som en surhetsregulator. Det används som torkmedel i kemiska metoder för att mäta vattenånggenomsläppligheten hos vissa tyger..
Det fungerar som ett uttorkningsmedel för etanol vid produktion av denna alkohol med utgångspunkt från lignocellulosa, ett material som härrör från trä..
Det används för att producera antibiotika och används ofta i brandbekämpningsutrustning.
Inom polymerindustrin
Det används för att återvinna polyuretaner eftersom det tjänar till att katalysera eller påskynda hydrolys- och glykolysreaktionerna hos nämnda polymerer så att de blir alkoholer och aminer.
Det används också vid produktion av organiska silikonhartser.
I vetenskapliga och medicinska forskningslaboratorier
Kaliumacetat med hög renhet används i laboratorier som ett reagens i analytisk kemi. Också för att utföra medicovetenskaplig forskning.
I histopatologilaboratorier används det för att säkerställa ett neutralt pH-medium i mikroskopuppsättningar..

Den används för syntes av heterocykliska organiska föreningar, som är föreningar med olika storlekscykler..
Vissa mikroelektroder som används för att studera de elektriska egenskaperna hos celler är fyllda med en koncentrerad lösning av kaliumacetat..
I den industriella produktionen av antikroppar
Kaliumacetat används för storskalig produktion av monoklonala antikroppar (som är de som kommer från samma stamcell) i cellkulturer. Tillåter att stimulera syntes eller bildning av antikroppar.
Antikroppar är ämnen som produceras av vissa celler i blodet för att bekämpa infektioner från virus eller bakterier..

I frostskyddsblandningar
Kaliumacetat har använts i frostskyddsblandningar. isbildning) för att använda dem för att smälta is på vägar och cementbeläggningar och därmed möjliggöra en säker användning av dessa.

Valet av kaliumacetat (AcOK) för denna applikation beror på det faktum att en 50 viktprocent vattenlösning av AcOK är eutektisk och har en smältpunkt på -62 ° C. Detta innebär att även vid temperaturer så låga som -62 ° C förblir lösningen smält..
En eutektik är en homogen blandning av komponenter som har den lägsta smältpunkten av alla möjliga blandningar av dessa, inklusive de av de rena komponenterna..
Hur det fungerar som ett frostskyddsmedel
Kaliumacetat (AcOK) har en mycket god förmåga att smälta is.
Vid -5 ° C kan den smälta 11,5 kg is för varje kg AcOK. Denna egenskap minskar när temperaturen sjunker, men även vid -50 ° C har den förmågan att smälta 1,3 kg is för varje kg AcOH..
Vid -5 ° C är denna kapacitet jämförbar med den för natriumklorid eller bordssalt (NaCl), medan den från -30 ° C långt överstiger den.

I de tester som utförts med AcOK tillsammans med andra föreningar observerades emellertid en viss grad av korrosion av cementytorna, så man ansåg att tillsätta antikorrosiva medel till frostskyddsblandningarna..
Å andra sidan blandningen av kaliumacetat (CH3COOK) med kaliumformiat (HCOOK) är ett utmärkt frostskyddsmedel och kräver inte korrosionsskyddsmedel.
Referenser
- Baker, F.J. et al. (1976). Färgningsprocedurer. Vattenhaltiga bergmedel. I introduktion till medicinsk laboratorieteknik (femte upplagan). Återställd från sciencedirect.com.
- Hassan, A.A. et al. (2018). Indazoler: syntes och bindningsformande heterocyklisering. Framsteg inom heterocyklisk kemi. Återställd från sciencedirect.com.
- USA National Library of Medicine. (2019). Kaliumacetat. Återställd från pubchem.ncbi.nlm.nih.gov.
- Das, A. och Alagirusamy, R. (2010). Fuktöverföring. Torkmedel inverterad koppmetod. In Science in Clothing Comfort. Återställd från sciencedirect.com.
- Vargel, C. (2004). Karboxylsyror och deras derivat. Acetater. I korrosion av aluminium. Återställd från sciencedirect.com.
- Cuevas, J. (2014). Elektrofysiologiska inspelningstekniker. Intracellulära inspelningstekniker. I referensmodul i biomedicinsk vetenskap. Återställd från sciencedirect.com.
- Fink, J.K. (2018). Poly (uretan) s. Återvinning. Solvolys. I Reactive Polymers: Fundamentals and Applications (tredje upplagan). Återställd från sciencedirect.com.
- Fong, W. et al. (1997). Optimering av monoklonal antikroppsproduktion: kombinerade effekter av kaliumacetat och perfusion i en omrörd tankbioreaktor. Cytoteknik 24: 47-54. Återställd från link.springer.com.
- Danilov, V.P. et al. (2012). Anti-isande reagenser vid låg temperatur i vattenhaltiga saltsystem innehållande acetat och formiater. Theoretical Foundations of Chemical Engineering, 2012, Vol 46, nr 5, pp. 528-535. Återställd från link.springer.com.
- Fakeev, A.A. et al. (2012). Forskning och utveckling av metoden för kaliumacetat med hög renhet. Journal of Applied Chemistry, 2012, Vol. 85, nr 12, s. 1807-1813. Återställd från link.springer.com.



Ingen har kommenterat den här artikeln än.