
Natriumacetatstruktur, egenskaper, syntes, användningsområden

De natriumacetat är ett natriumsalt av ättiksyra vars molekylformel är CtvåH3ELLERtvåNa. Den består av ett smakfullt vitt pulver, huvudsakligen närvarande i två former: vattenfritt och trihydrerat. Båda är mycket lösliga i vatten, det universella lösningsmedlet; men inte så löslig i alkoholer eller aceton.
Den vattenfria formen har en densitet, en smältpunkt och en kokpunkt med högre värden än de som presenteras av trihydratformen av natriumacetat. Detta beror på att vattenmolekylerna interfererar mellan interaktionerna mellan Na-jonerna.+ och CH3KUTTRA-.

Natriumacetat är stabilt, speciellt vid förvaring mellan 2 och 8 ° C; men det är mottagligt för verkan av starka oxidationsmedel och halogener.
Det kan framställas genom reaktion av natriumbikarbonat med ättiksyra. Även med reaktionen av ättiksyra med natriumhydroxid. Båda reaktionerna är enkla att producera och billiga; det första kan till och med göras hemma.
Detta salt är en låg toxisk förening. Producerar hudirritation, endast efter frekvent och kontinuerlig kontakt. Det är lätt irriterande för ögonen men kan irritera luftvägarna. Det finns ingen information om skadlig effekt av dess intag..
Den har många användningsområden och applikationer, vilket lyfter fram dess pH-buffrande funktion, tillsammans med ättiksyra. Acetatbufferten har ett pKa = 4,7; vilket ger hög effektivitet vid pH-reglering i en sur miljö med pH-värden mellan 3 och 6.
På grund av dess låga toxicitet och dess egenskaper har det använts i stor utsträckning för att förbättra matens smak, liksom ett medel som ger skydd mot förstöring på grund av dess verkan mot mikrober..
Artikelindex
- 1 Struktur av natriumacetat
- 1.1 Hydrerade kristaller
- 2 fastigheter
- 2.1 Namn
- 2.2 Molmassa
- 2.3 Utseende
- 2.4 Lukt
- 2.5 Densitet
- 2.6 Smältpunkt
- 2.7 Kokpunkt
- 2.8 Löslighet
- 2.9 Surhet
- 2.10 Grundläggande
- 2.11 Brytningsindex (ηD)
- 2.12 Kalorikapacitet
- 2.13 Flampunkt
- 2.14 Självantändningstemperatur
- 2,15 pH
- 2.16 Stabilitet
- 2.17 Reaktioner
- 3 Syntes
- 4 användningsområden
- 4.1 Värmepåsar
- 4.2 Industriell
- 4.3 Medicinsk användning
- 4,4 pH-buffertlösning
- 4.5 Forskningslaboratorier
- 4.6 Livsmedelsbevarande
- 4.7 Konservering av betong
- 5 Experiment för ungdomar
- 5.1 Experiment 1
- 5.2 Experiment 2
- 6 Toxicitet
- 7 Referenser
Struktur av natriumacetat
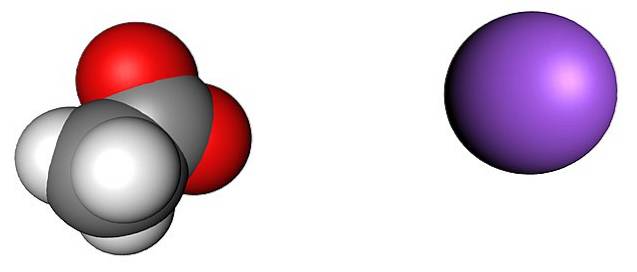
Bilden ovan visar jonerna som utgör vattenfria natriumacetatkristaller (utan vatten). Den lila sfären motsvarar Na-katjonen+, och den molekylära jonen till vänster är acetat, CH3KUTTRA-, med sina syreatomer representerade av röda sfärer.
Dessa par, enligt formeln CH3COONa, är i förhållandet 1: 1; för varje CH-anjon3KUTTRA-, det måste finnas en Na-katjon+ lockas av dess negativa laddning och vice versa. Således slutar attraktionerna mellan dem och avstötningarna mellan lika laddningar att skapa strukturella mönster som definierar en kristall, vars minsta uttryck är enhetscellen.
Nämnda enhetscell, liksom kristallen som helhet, varierar beroende på jonernas arrangemang i rymden; det är inte alltid detsamma, inte ens för samma kristallina system. Till exempel kan vattenfritt natriumacetat bilda två ortorombiska polymorfer, av vilka en avbildas nedan:
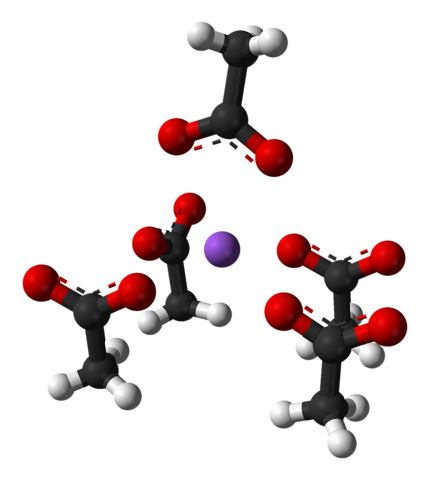
Observera arrangemanget av jonerna: fyra CH-joner3KUTTRA- de låser upp en Na+ på ett sådant sätt att de "ritar" en förvrängd fyrkantig pyramid. Var och en av dessa kap3KUTTRA- i sin tur interagerar de med en annan Na+ intilliggande.
Hydrerade kristaller
Natriumacetat har hög affinitet för vatten; i själva verket är det delikat, det vill säga det behåller fukt tills det löser sig i det. Ju högre luftfuktighet, desto snabbare smälter den. Detta beror på att både CH3KUTTRA- som Na+ kan hydrera, omge sig med vattenmolekyler som orienterar sina dipoler mot deras laddningar (Na+ Åhtvå, CH3KUTTRA- HOH).
När detta salt bereds i laboratoriet eller hemma är dess affinitet för vatten sådan att det redan vid normala temperaturer erhålls som ett hydrat; CH3COONa 3HtvåO. Dess kristaller slutar vara ortorombiska och blir monokliniska, eftersom de nu innehåller tre vattenmolekyler för varje CH-par3KUTTRA- och Na+.
Egenskaper
Namn
-Natriumacetat.
-Natriumetanoat (IUPAC).
Molmassa
-Vattenfri: 82,03 g / mol.
-Trihydrat: 136,03 g / mol.
Utseende
Läckert vitt pulver.
Odör
Till ättika vid upphettning till nedbrytning.
Densitet
-Vattenfri: 1,528 g / cm3 vid 20 ºC.
-Trihydrat: 1,45 g / cm3 vid 20 ºC.
Smältpunkt
-Vattenfri: 324 ºC (615 ºF, 597 K).
-Trihydrat: 58 ºC (136 ºF, 331 K).
Kokpunkt
-Vattenfri: 881,4 ºC (1,618,5 ºF, 1,154,5 K).
-Trihydrat: 122 ° C (252 ° F, 395 K). Det sönderfaller.
Löslighet
I vatten
-Vattenfri: 123,3 g / 100 ml vid 20 ° C.
-Trihydrat: 46,4 g / 100 ml vid 20 ° C.
I metanol
16 g / 100 g vid 15 ºC.
I etanol
5,3 g / 100 ml (trihydrat).
I aceton
0,5 g / kg vid 15 ° C.
Aciditet
pKa: 24 (20 ºC).
Grundläggande
pKb: 9,25. Här bevisas att natriumacetat är ett basiskt salt eftersom det har pKb mindre än dess pKa.
Brytningsindex (ηD)
1.464
Kaloriförmåga
-100,83 J / mol K (vattenfri).
-229,9 J / mol K (trihydrat).
antändningspunkt
Över 250ºC.
Självantändningstemperatur
600 ºC.
pH
8,9 (0,1 M lösning vid 25 ° C).
Stabilitet
Stabil. Oförenlig med starka oxidationsmedel och halogener. Känslig för fuktighet.
Reaktioner
Natriumacetat kan bilda en ester genom att reagera med en alkylhalogenid; till exempel bromoetan:
CH3COONa + BrCHtvåCH3 => CH3COOCHtvåCH3 + NaBr
Natriumacetatdekarboxylater till metan (pyrolys) i närvaro av NaOH:
CH3COONa + NaOH => CH4 + NatvåCO3
Reaktionen katalyseras av cesiumsalter.
Syntes
Natriumacetat kan produceras billigt i laboratoriet genom att reagera natriumbikarbonat med ättiksyra:
NaHCO3 + CH3COOH => CH3COONa + HtvåCO3
Denna reaktion åtföljs av närvaron i lösningen av en intensiv bubbla på grund av nedbrytningen av kolsyra i vatten och koldioxid..
HtvåCO3 => HtvåO + COtvå
Industriellt produceras natriumacetat genom att reagera ättiksyra med natriumhydroxid.
CH3COOH + NaOH => CH3COONa + HtvåELLER
Applikationer
Termiska väskor
Natriumacetat används för att tillverka termiska påsar.
Initialt löses saltkristallerna i en volym vatten för att framställa en lösning som blir övermättad..
Därefter upphettas lösningen till en temperatur högre än 58 ° C, vilket är dess smältpunkt. Den övermättade lösningen får svalna till rumstemperatur och kristallbildning observeras inte; lösningen är superkyld.
Frånvaron av kristaller förklaras av det faktum att vätskans molekyler är för oroliga och inte har rätt orientering för att nå kristallisationstemperaturen. Vätskan är i ett metastabilt tillstånd, ett tillstånd av obalans.
Med tanke på instabiliteten hos den superkylda vätskan är varje störning tillräcklig för att initiera kristallisation. När det gäller termiska påsar pressas en mekanisk fastsättning för att omröra vätskan och initiera kristallbildning och stelning av natriumacetattrihydratlösningen..
När kristallisation sker ökar temperaturen. Natriumacetattrihydratkristaller ser ut som is, men de är heta, varför det kallas "het is.".
Industriell
-Natriumacetat används i textilindustrin som ett mordant i tygfärgningsprocessen
-Neutraliserar svavelsyravfall
-Den används vid bearbetning av bomull för produktion av bomullsdynor, användbar vid personlig rengöring och för medicinska ändamål
-Det används vid betning av metaller före förkromning
-Samarbetar så att vulkanisering av kloropren inte sker i tillverkningsprocessen av syntetiskt gummi
-Går in i rening av glukos
-Det används vid garvning av läder.
Medicinsk användning
Natriumacetat är en av de föreningar som används för att leverera elektrolyter som ges till patienter intravenöst..
Det används för att korrigera natriumnivåer hos hyponatremiska patienter, även för korrigering av metabolisk acidos och alkalisering av urinen..
PH buffertlösning
Det används som en pH-regulator i många enzymatiska reaktioner som uppstår mellan pH 3 och pH 6.
Det olika pH-värdet för acetatbuffertlösningen uppnås genom variationen i koncentrationen av ättiksyra och natriumacetat..
För att exempelvis, för att erhålla ett pH 4,5, har buffertlösningen en ättiksyra-koncentration av 3,8 g / L och en vattenfri natriumacetatkoncentration av 3,0 g / L..
Koncentrationen av acetatbufferten kan ökas, och i samma proportion ökar komponenterna i lösningen som är nödvändiga för att erhålla önskat pH.
Acetat / acetonitrilbuffert används vid kapillärelektrofores vid separering av fotoberberiner.
Forskningslaboratorier
-Natriumacetat är ett svagt nukleofilt medel som används vid anjonisk polymerisation av β-lakton.
-Det används som ett reagens i kärnmagnetisk resonans hos biologiska makromolekyler.
-Det används vid extraktion av DNA från celler. Natrium är en katjon som interagerar med de negativa laddningarna av fosfater som finns i DNA, vilket hjälper till att kondensera dem. I närvaro av etanol bildar DNA en fällning som sedan kan separeras i det vattenhaltiga skiktet.
Livsmedelsbevarande
-Hjälper till att förhindra bakterietillväxt, förutom att förhindra alstring av överskott av syra som orsakar matförstöring och därmed bibehålla ett specifikt pH.
-Natrium som finns i acetat förstärker smaken av maten.
-Natriumacetat används vid beredning av inlagda grönsaker: gurka, morot, lök etc. Dessutom används det för konservering av kött.
Konservering av betong
Betong skadas av vattenets verkan, vilket förkortar dess varaktighet. Natriumacetat fungerar som ett betongtätningsmedel som gör det vattentätt och förlänger dess ursprungliga egenskaper.
Ungdomsexperiment
Experiment 1
Ett enkelt experiment är syntesen av natriumacetat genom att reagera natriumbikarbonat med ättika (5% ättiksyra).
30 ml vinäger placeras i en bägare och cirka 3,5 g bikarbonat tillsätts..
Natriumacetat och kolsyra bildas i reaktionen. Syra bryts ner till koldioxid och vatten. Genereringen av koldioxid kommer att ge en intensiv bubbla i lösningen.
För att samla upp natriumacetatet avdunstar vattnet och värmer upp lösningen.
Experiment 2
Ett annat enkelt experiment är bildandet av kristaller av natriumacetattrihydrat.
För att göra detta vägs cirka 20 g natriumacetattrihydrat och placeras i en bägare och sedan tillsätts 10 ml vatten. Lösningen värms upp till en temperatur över 58 ºC.
Natriumacetat är helt upplöst för att säkerställa att lösningen är övermättad. Tidigare placeras en Pietri-skål på en kall yta.
Innehållet i bägaren med acetattrihydratet hälls långsamt i Pietri-skålen. Vätskans temperatur i kapseln börjar sjunka, till och med under smältpunkten, utan att kristallisationen eller stelningen av natriumacetattrihydratet observeras..
Vanligtvis tillsätts en liten mängd salt för att ge kristallisation av natriumacetattrihydratet för att fungera som kristallisationskärnan. Andra gånger inträffar en liten störning av lösningen för att initiera kristallisationen av natriumacetat.
Natriumacetattrihydratkristaller ser ut som is, men om du rör vid dem kommer du att märka att de är relativt heta. Av denna anledning kallas salt "het is".
Giftighet
Natriumacetat är en mycket låg toxisk förening. Det klassificeras inte heller som hud- och andnings sensibilisering..
Dessutom klassificeras inte natriumacetat som ett könscellsmutagena, cancerframkallande eller reproduktionstoxiska medlet..
Kort sagt, det är något irriterande för ögonen. Andningsvägarna kan irritera efter inandning. Frekvent och konstant kontakt med huden kan orsaka irritation.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- WorldOfChemicals. (16 januari 2017). Hur förbereder jag natriumacetat hemma? Återställd från: medium.com
- Nationellt centrum för bioteknikinformation. (2019). Natriumacetat. PubChem-databas. CID = 517045. Återställd från: pubchem.ncbi.nlm.nih.gov
- S. Cameron, K. M. Mannan och M. O. Rahman. (1976). Kristallstrukturen av natriumacetat-trihydrat. Acta Cryst. B32, 87.
- Wikipedia. (2019). Natriumacetat. Återställd från: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (24 januari 2019). Gör varm is från vinäger och bakpulver. Återställd från: thoughtco.com
- Kemikaliebok. (2017). Natriumacetat. Återställd från: chemicalbook.com
- Wasserman Robin. (2019). Användning av natriumacetat. Återställd från: livestrong.com
- Drugbank. (2019). Natriumacetat. Återställd från: drugbank.ca



Ingen har kommenterat den här artikeln än.