
Primär alkoholstruktur, egenskaper, nomenklatur, exempel
A primär alkohol är en i vilken hydroxylgruppen är bunden till ett primärt kol; det vill säga ett kol kovalent bundet till ett annat kol och väten. Dess allmänna formel är ROH, specifikt RCHtvåOH, eftersom det bara finns en alkylgrupp R.
R-gruppen med formeln RCHtvåOH kan vara vilken som helst: en kedja, en ring eller heteroatomer. När det gäller en kedja, kort eller lång, har vi att göra med de mest representativa primära alkoholerna; bland dem är metanol och etanol, två av de mest syntetiserade på industriell nivå.

Fysiskt är de som andra alkoholer, och deras kok- eller smältpunkter beror på graden av deras förgrening; men kemiskt sett är de mest reaktiva. Dessutom är dess surhet högre än för sekundära och tertiära alkoholer.
Primära alkoholer genomgår oxidationsreaktioner och blir ett stort antal organiska föreningar: estrar och etrar, aldehyder och karboxylsyror. På samma sätt kan de genomgå uttorkningsreaktioner och omvandlas till alkener eller olefiner.
Artikelindex
- 1 Struktur av en primär alkohol
- 2 fastigheter
- 2.1 Surhet
- 2.2 Kemiska reaktioner
- 3 Nomenklatur
- 4 Exempel
- 5 Referenser
Struktur av en primär alkohol
De primära alkoholerna härledda från linjära alkaner är de mest representativa. I verkligheten kan dock vilken struktur som helst, oavsett om den är linjär eller grenad, klassificeras inom denna typ av alkoholer så länge OH-gruppen är kopplad till en CHtvå.
Så strukturellt har de alla gemensamt närvaron av gruppen -CHtvåOH, kallad metylol. En egenskap och konsekvens av detta faktum är att OH-gruppen är mindre hindrad; det vill säga det kan interagera med miljön utan rumslig inblandning från andra atomer.
På samma sätt betyder en mindre hindrad OH att kolatomen som bär den, den för CHtvå, kan genomgå substitutionsreaktioner genom en SN-mekanismtvå (bimolekylär, utan bildande av en karbokation).
Å andra sidan översätts en OH med större frihet att interagera med mediet som starkare intermolekylära interaktioner (av vätebindningar), vilket i sin tur ökar smält- eller kokpunkterna.
Detsamma händer med dess löslighet i polära lösningsmedel, så länge R-gruppen inte är särskilt hydrofob..
Egenskaper
Aciditet
De primära alkoholerna är av alla de suraste. För att en alkohol ska fungera som en Bronsted-syra måste du donera en H-ion+ till mediet, för att säga vatten, för att bli en alkoxidanjon:
ROH + HtvåELLER <=> RO- + H3ELLER+
Den negativa laddningen av RO-, specifikt från RCHtvåELLER-, är mindre avstötad av elektronerna i de två CH-bindningarna än av elektronerna i CR-bindningen.
Alkylgruppen utövar sedan den största avstötningen, destabiliserande RCHtvåELLER-; men inte så mycket jämfört med att om det fanns två eller tre R-grupper, vilket sker med sekundära respektive tertiära alkoholer.
Ett annat sätt att förklara den högre surheten hos en primär alkohol är genom elektronegativitetsskillnaden, vilket skapar dipolmomentet: HtvåC5+-ELLER5-H. Syre drar till sig elektrontätheten från båda CHtvå från H; den positiva partiella laddningen av kol stöter bort något av väte.
R-gruppen överför en del av sin elektrontäthet till CHtvå, vilket hjälper till att minska dess positiva partiladdning och därmed dess avstötning för väteladdningen. Ju fler R-grupper det finns, desto lägre är avstötningen och därför är tendensen hos H att frigöras som H+.
pKa
Primära alkoholer anses vara svagare syror än vatten, med undantag av metylalkohol, som är något starkare. PKa för metylalkohol är 15,2; och pKa för etylalkohol är 16,0. Under tiden är pKa vatten 15,7.
Vatten, som anses vara en svag syra, som alkoholer, kan dock bindas till H+ att transformera till hydroniumjonen, H3ELLER+; det vill säga, det beter sig som en bas.
På samma sätt kan primära alkoholer ta upp väte; speciellt i några av sina egna reaktioner, till exempel i dess omvandling till alkener eller olefiner.
Kemiska reaktioner
Bildning av alkylhalogenider
Alkoholer reagerar med vätehalider för att producera alkylhalider. Reaktiviteten hos alkoholer mot vätehalogenider minskar i följande ordning:
Tertiär alkohol> sekundär alkohol> primär alkohol
ROH + HX => RX + HtvåELLER
RX är en primär alkylhalogenid (CH3Cl, CH3CHtvåBr, etc.).
Ett annat sätt att framställa alkylhalogenider är genom att reagera tionylklorid, ett syntetiskt reagens, med en primär alkohol som omvandlas till en alkylklorid. Tionylklorid (SOCltvå) kräver närvaron av pyridin för att reagera.
CH3(CHtvå)3CHtvåOH + SOCltvå => CH3(CHtvå)3CHtvåCl + SOtvå + HCl
Denna reaktion motsvarar halogeneringen av 1-pentanol för att bli 1-klorpentan i närvaro av pyridin.
Oxidation av primära alkoholer
Alkoholer kan oxideras till aldehyder och karboxylsyror, beroende på reagens. Pyridiniumklorokromat (PCC) oxiderar primäralkohol till aldehyd med hjälp av diklormetan (CHtvåCltvå):
CH3(CHtvå)5CHtvåOH => CH3(CHtvå)5COH
Detta är oxidationen av 1-heptanol till 1-heptanal.
Under tiden kaliumpermanganat (KMnO4) oxiderar först alkoholen till aldehyd och oxiderar sedan aldehyden till karboxylsyra. När kaliumpermanganat används för att oxidera alkoholer måste brytningen av bindningen mellan kol 3 och 4 undvikas..
CH3(CHtvå)4CHtvåOH => CH3(CHtvå)4COOH
Detta är oxidationen av 1-hexanol till hexansyra.
Med denna metod är det svårt att erhålla en aldehyd, eftersom den lätt oxideras till en karboxylsyra. En liknande situation observeras när kromsyra används för att oxidera alkoholer.
Bildande av etrar
Primära alkoholer kan omvandlas till etrar vid upphettning i närvaro av en katalysator, vanligtvis svavelsyra:
2 RCHtvåOH => RCHtvåOCHtvåR + HtvåELLER
Bildning av organiska estrar
Kondensationen av en alkohol och en karboxylsyra, Fishers förestring, katalyserad av en syra, ger en ester och vatten:
R'OH + RCOOH <=> RCOOR '+ HtvåELLER
En välkänd reaktion är den av etanol med ättiksyra för att ge etylacetat:
CH3CHtvåOH + CH3COOH <=> CH3COOHCHtvåCH3 + HtvåELLER
Primäralkohol är den mest mottagliga för Fischer-förestringsreaktioner.
Uttorkning
Vid höga temperaturer och i ett surt medium, i allmänhet svavelsyra, torkar alkoholer ut för att bilda alkener med förlusten av en vattenmolekyl.
CH3CHtvåOH => HtvåC = CHtvå + HtvåELLER
Detta är uttorkningsreaktionen av etanol till eten. En mer lämplig allmän formel för denna typ av reaktion, speciellt för en primär alkohol, skulle vara:
RCHtvåOH => R = CHtvå (vilket också är lika med RC = CHtvå)
Nomenklatur
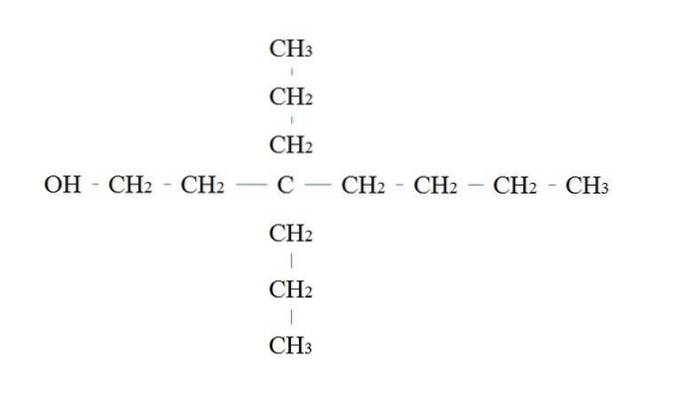
Reglerna för namngivning av en primär alkohol är desamma som för de andra alkoholerna. med undantaget att det ibland inte är nödvändigt att lista det OH-bärande kolet.
I den övre bilden finns en huvudkedja med sju kol. Kolet bundet till OH tilldelas numret 1 och sedan räknas det från vänster till höger. Dess IUPAC-namn är därför: 3,3-dietylheptanol.
Observera att detta är ett exempel på en mycket grenad primäralkohol.
Exempel
Slutligen nämns några primära alkoholer baserat på deras traditionella och systematiska nomenklatur:
-Metyl, CH3Åh
-Etyl, CH3CHtvåÅh
-n-propyl, CH3CHtvåCHtvåÅh
-n-hexyl, CH3CHtvåCHtvåCHtvåCHtvåCHtvåÅh
Dessa är derivat av linjära alkaner. Andra exempel är:
-2-fenyletanol, C6H5CHtvåCHtvåOH (C6H5 = bensenring)
-2-propen-1-ol (allylalkohol), CHtvå= CHCHtvåÅh
-1,2-etandiol, CHtvåOHCHtvåÅh
-2-kloroetanol (etylenklorhydrin), ClCHtvåCHtvåÅh
-2-buten-1-ol (crotylalkohol), CH3CH = CHCHtvåÅh
Referenser
- Morrison, R.T. och Boyd, R. N. (1987). Organisk kemi. (5ta Utgåva). Addison-Wesley Iberoamericana
- Carey, F. A. (2008). Organisk kemi. (6ta Utgåva). McGraw-Hill, Interamerica, Editores S.A.
- Mel Science. (2019). Hur oxidationen av primära alkoholer sker. Återställd från: melscience.com
- Royal Society of Chemistry. (2019). Definition: primära alkoholer. Återställd från: rsc.org
- Chriss E. McDonald. (2000). Oxidationen av primära alkoholer till estrar: Tre relaterade undersökande experiment. J. Chem. Educ., 2000, 77 (6), s 750. DOI: 10.1021 / ed077p750



Ingen har kommenterat den här artikeln än.