
Kolallotroper amorft kol, grafit, grafener, nanorör

De kolallotroper de är de olika fysiska formerna där deras atomer kan ordnas och länkas. Var och en motsvarar en fast substans med sina egna speciella egenskaper. Molekylärt och strukturellt skiljer de sig från varandra. Det finns två huvudtyper av dessa allotroper: kristallina och amorfa..
Kristallina allotroper är de som har ett upprepande mönster av sina atomer i rymden. Under tiden, i amorfa allotroper, är atomerna ordnade ordentligt, utan att det finns två identiska regioner i det fasta ämnet. Så de första är beställda och de andra är röriga.
(https://creativecommons.org/licenses/by-sa/4.0)]
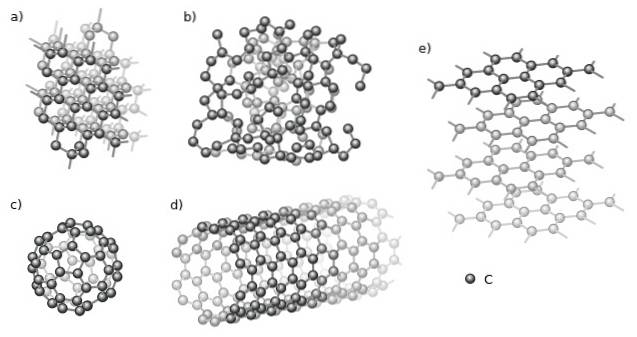
Bland de kristallina är diamant (a) och grafit (e) par excellence. I den övre bilden observeras olika strukturer som har en gemensam aspekt: de består endast av kolatomer (svarta sfärer).
Och bland de amorfa allotroperna har vi det amorfa kolet (b), som, som man kan se, dess struktur är orolig. Det finns dock många typer av amorfa kol, så det är en familj av fasta ämnen..
Kolatomer kan också bilda supramolekyler, såsom fullerener (c) och nanorör (d). Dessa supramolekyler kan variera i storlek och form, men de har samma geometrier; sfärisk och rörformig för fullerener respektive nanorör.
Artikelindex
- 1 Kovalenta bindningar av kol
- 1.1 Sexhörningar
- 1.2 Tetrahedra
- 2 amorft kol
- 2.1 Politik
- 2.2 Funktionella grupper
- 3 Grafit
- 3.1 Fysiska egenskaper
- 4 diagram
- 5 kolnanorör
- 5.1 Strukturella konformationer
- 6 Fullerener
- 7 Referenser
Kovalenta bindningar av kol
Innan du tar upp några av de kända allotroperna av kol är det nödvändigt att granska hur kolatomer binder..
Enligt valensbindningsteorin har kol fyra elektroner i sitt valensskal, med vilka de bildar kovalenta bindningar. Tack vare elektronisk marknadsföring och hybridisering kan de fyra elektronerna placeras i fyra separata orbitaler, vare sig de är rena eller hybrid.
Därför har kol förmågan att bilda upp till maximalt fyra bindningar.
DC. Genom att ha fyra C-C-bindningar når atomerna valensoktet och de blir mycket stabila. Detta betyder dock inte att det inte bara kan finnas tre av dessa länkar, som de som ses i hexagoner..
Sexhörningar
Beroende på hybridiseringarna av kolatomen kan dubbel- eller trippelbindningar hittas i strukturen för deras respektive allotroper. Men ännu tydligare än förekomsten av sådana bindningar är geometrin som kolerna antar.
Till exempel, om en hexagon observeras betyder det att kolen har sp-hybridiseringtvå och har därför en orbital sid ren med en ensam elektron. Kan du se perfekta hexagoner i den första bilden? De allotropes som innehåller dem antyder att deras kol är sptvå, huruvida det finns dubbelbindningar (t.ex. bensenringen).
Ett nät, plan eller sexkantigt lager består sedan av sp-koltvå som har ett elektroniskt "tak" eller "moln", en produkt av den oparade elektronen i banan sid. Denna elektron kan bilda kovalenta bindningar med andra molekyler eller locka de positiva laddningarna av metalljoner; som K+ och Na+.
På samma sätt tillåter dessa elektroner att dessa skal staplas ovanpå varandra utan bindning (på grund av en geometrisk och rumslig hinder för överlappningen av de två orbitalerna sid). Detta innebär att allotroper med hexagonala geometrier kan eller inte kan beordras att bygga en kristall..
Tetrahedra
Om en tetraeder observeras, vilket kommer att förklaras i det sista avsnittet, betyder det att kolen har sp-hybridisering3. I dem finns fyra enstaka C-C-bindningar, och de bildar ett tetrahedralt kristallgitter. I sådana tetraeder finns det inga fria elektroner som det finns i hexagoner..
Amorft kol

Amorft kol kan föreställas som en slags porös svamp, med massor av godtyckligt anordnade sexkantiga och tetraedriska nätverk. I denna mineralmatris kan de fånga andra element som kan komprimera eller expandera nämnda svamp; och på samma sätt kan dess strukturella kärnor vara större eller mindre.
Beroende på% kol härleds sålunda olika typer av amorfa kol; såsom sot, kol, antracit, kolsvart, torv, koks och aktivt kol.
Vid första anblicken ser de alla fjärrliknande ut (översta bilden), med graderingar till kanten av svarta, tråkiga eller metalliska och gråaktiga övertoner..
Inte alla amorfa kol har samma ursprung. Vegetabiliskt kol är, som namnet antyder, en produkt av förbränning av vegetabiliska massor och trä. Medan kolsvart och koks är produkter i olika stadier och tillstånd av petroleumprocesser..
Även om de inte verkar särskilt attraktiva och man kan tro att de endast fungerar som bränslen, lockar porositeten hos deras fasta ämnen uppmärksamhet vid tekniska reningsapplikationer, såsom absorbenter och substanslagring, och även som katalytiska bärare..
Politypism
Strukturerna hos amorfa kol är komplexa och oroliga; men kristallografiska studier har visat att de i verkligheten är tetraedriska (diamant) och sexkantiga (grafit) polytyper, ordnade godtyckligt i lager.
Till exempel, om T och H är de tetrahedrala respektive hexagonala skikten, kan ett amorft kol strukturellt beskrivas som: THTHHTH; eller HTHTTHTHHHT, etc. Vissa T- och H-skiktsekvenser definierar en typ av amorft kol; men inom dem finns det ingen upprepande trend eller mönster.
Det är av denna anledning som det är strukturellt svårt att karakterisera dessa kolallotroper; och istället för det föredras dess% kol, vilket är en variabel som underlättar dess skillnader, förutom dess fysiska egenskaper och dess tendens att brinna eller brinna.
Funktionella grupper
Det nämndes att sexkantiga plan har en oparad elektron med vilken den kan bilda en bindning med andra molekyler eller atomer. Om, för att säga, de omgivande molekylerna är HtvåO och COtvå, OH- och COOH-grupper kan förväntas bildas, respektive. De kan också binda till väteatomer och bilda CH-bindningar..
Möjligheterna är mycket varierade, men sammanfattningsvis kan amorfa kol innehålla syresatta funktionella grupper. När dessa heteroatomer är närvarande är de inte bara placerade på planens kanter utan också och även inuti.
Grafit

Bilden ovan visar en modell med sfärer och strängar av grafitens kristallstruktur. Lyckligtvis hjälper sfärernas skuggor att visualisera π-molnen som ett resultat av avlokaliseringen av deras oparade elektroner. Detta nämndes i det första avsnittet, utan så många detaljer.
Dessa π moln kan jämföras med två system: bensenringar och "elektronhav" i metallkristaller..
Orbitaler sid de går med varandra för att bygga ett spår där elektroner färdas fritt; men endast mellan två sexkantiga lager; vinkelrätt mot dem, det finns inget flöde av elektroner eller ström (elektronerna måste passera genom kolatomerna).
Eftersom det sker en konstant migrering av elektroner bildas ständiga ögonblickliga dipoler som inducerar andra dipoler av kolatomer som är över eller under; det vill säga skikten eller arken av grafit förblir tillsammans tack vare Londons spridningskrafter..
Dessa sexkantiga skikt, som kan förväntas, skapar en sexkantig grafitkristall; eller snarare en serie små kristaller kopplade i olika vinklar. Π-molnen beter sig som om de vore ett "elektriskt smör", vilket låter skikten glida innan någon yttre störning på kristallerna.
Fysikaliska egenskaper
De fysiska egenskaperna hos grafit är lätta att förstå när dess molekylära struktur har behandlats..
Till exempel är grafitens smältpunkt mycket hög (över 4400 ° C), eftersom energin som tillförs i form av värme måste oåterkalleligt separera de sexkantiga skikten och även bryta deras sexkanter..
Det sa bara att deras lager kan glida över varandra; Och inte bara utan de kan också hamna ovanpå andra ytor, såsom cellulosan som utgör papperet när de deponeras från pennornas grafit. Denna egenskap gör att grafit kan fungera som ett utmärkt smörjmedel..
Och som redan nämnts är det en bra ledare för elektricitet, och även av värme och ljud..
Grafen

Även om det inte visades i den första bilden, kan denna kolototrop inte utelämnas. Anta att grafitlagren greppades och kondenserades till ett enda ark, öppet och täckte ett stort område. Om detta gjordes molekylärt skulle grafen födas (övre bild).
Så grafen är ett enskilt grafitark, som inte interagerar med andra och kan vinka som en flagga. Observera att den liknar väggarna i bikakorna hos bin.
Dessa grafenark bevarar och multiplicerar grafits egenskaper. Dess sexhörningar är mycket svåra att separera, varför de uppvisar ett avgrundsmekaniskt motstånd; ännu högre än stål. Dessutom är de extremt lätta och tunna, och teoretiskt skulle ett gram av dem räcka för att täcka en hel fotbollsplan..
Om du tittar på den översta bilden igen kan du se att det inte finns några dubbelbindningar. Visst kan det finnas dem, liksom trippelbindningar (graffiner). Det är här kemin i grafen öppnas, säg.
Liksom grafit och de andra sexkantiga skikten kan andra molekyler bindas kovalent till ytan av grafen och funktionalisera dess struktur för elektroniska och biologiska tillämpningar..
Kolnanorör
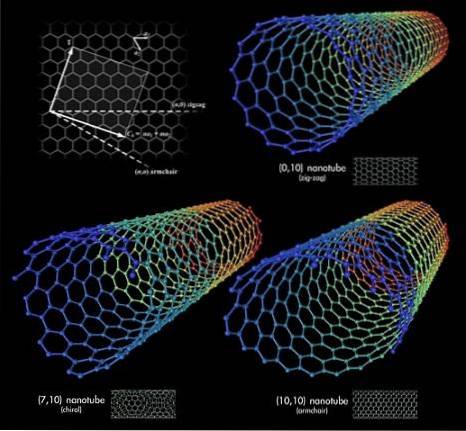
Antag att vi tog tag i grafenarken och började rulla dem till ett rör; Det här är kolnanorören. Längden och radien på dessa rör är varierande, liksom deras rumsliga konformationer. Tillsammans med grafen och fullerener utgör dessa nanorör triaden av de mest överraskande kolallotroperna.
Strukturella konformationer
Tre kolnanorör visas i den övre bilden. Vad är skillnaden mellan dem? Alla tre har sexkantiga mönstrade väggar och uppvisar samma ytegenskaper som redan diskuterats. Svaret ligger då i de sexkantens relativa riktningar.
Den första konformationen motsvarar sicksacktypen (övre högra hörnet). Om du tittar noga ser du att det har rader av sexhörningar placerade perfekt vinkelrätt mot rörets längdaxel..
Däremot för typkonformation fåtölj, eller stol (nedre högra hörnet), är hexagonerna ordnade i rader i samma riktning som rörets längdaxel. I det första nanoröret löper sexhörningarna över ytan i betydelsen av dess diameter, och i det andra nanoröret löper de längs ytan, från "ände till ände".
Och slutligen finns det det kirala nanoröret (nedre vänstra hörnet). Jämför en spiraltrappa som går åt vänster eller höger. Samma sak händer med detta kolnanorör: dess sexhörningar är ordnade uppåt till vänster eller höger. Eftersom det finns två rumsliga versioner sägs det då att det uppvisar chiralitet.
Fullerenes
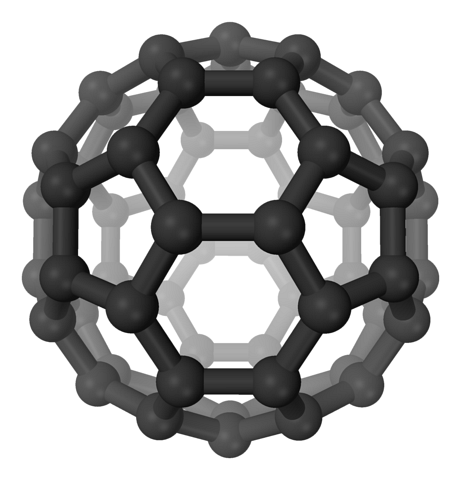
I fullerenerna upprätthålls fortfarande hexagonerna, men dessutom visas pentagonerna, alla med sp-koltvå. Arken eller lagren är redan kvar: nu har de vikts så att de bildar en boll, liknar en fotboll; och beroende på antalet kol, till en rugbyboll.
Fullerener är molekyler som skiljer sig åt i storlek. Den mest kända är C60 (översta bilden). Dessa kolallotroper bör behandlas som ballonger som kan pressas ihop för att bilda kristaller, i vilka joner och andra molekyler kan fångas i deras mellanrum..
Dessa kulor är speciella bärare eller stöd för molekyler. Hur? Genom de kovalenta bindningarna till dess yta, särskilt till de intilliggande kolerna i en sexkant. Fulleren sägs sedan ha funktionaliserats (en exohedral addukt).
Dess väggar kan brytas strategiskt för att lagra molekyler inuti; som liknar en sfärisk kapsel. Dessa bollar kan också ha sprickor och funktionaliseras samtidigt; allt beror på vilken applikation de är avsedda för.
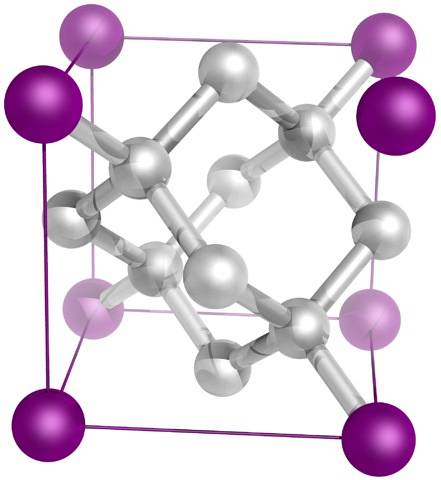
Och slutligen, den mest kända av alla allotroper av kol: diamant (även om inte alla är kol).
Strukturellt består den av kolatomer sp3, bildar fyra C-C-bindningar och ett tredimensionellt nätverk av tetraeder (övre bild) vars kristallina cell är kubisk. Det är det svåraste av mineraler och smältpunkten är nära 4000 ºC..
Dess tetraeder har förmåga att överföra värme effektivt genom kristallgitteret; men inte så med el, för dess elektroner är mycket väl belägna i dess fyra kovalenta bindningar och det kan inte gå någonstans. Därför är det en bra värmeledare, men det är en elektrisk isolator..
Beroende på hur den är facetterad kan den sprida ljus i många ljusa och attraktiva vinklar, varför de är eftertraktade som ädelstenar och smycken..
Nätverket är mycket resistent, eftersom det skulle behöva mycket tryck för att flytta sin tetraeder. Den här egenskapen gör det till ett material med hög mekanisk motståndskraft och hårdhet, som kan göra exakta och rena snitt, som med diamantspetsad skalpell..
Deras färger beror på deras kristallografiska defekter och deras orenheter.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Méndez Medrano, Ma. Guadalupe, Rosu, H. C., Torres González, L. A. (2012). Graphene: den mest lovande allotropen av kol. Universitetslagen. vol. 22, nr. 3, april-maj, 2012, sid. 20-23, University of Guanajuato, Guanajuato, Mexiko.
- IES La Magdalena. Aviles. Asturien. (s.f.). Allotropa former av kol. [PDF]. Återställd från: fisquiweb.es
- Wikipedia. (2019). Kolototroper. Återställd från: es.wikipedia.org
- Sederberg David. (s.f.). Allotropes av kol. Återställd från: web.ics.purdue.edu
- Sederberg, D. (2009). Allotropes av kol: Allt är på det sätt du är ihop. Återställd från: physics.purdue.edu
- Hirsh A. (2010). Era av kolallotroper. Institutionen för kemi och farmaci och tvärvetenskapligt centrum för molekylära material (ICMM), Friedrich-Alexander University Erlangen-Nürnberg, Henkestrasse 42, 91054 Erlangen, Tyskland.
- Styrelsen för regenter vid University of Wisconsin System. (2013). Nanorör och andra former av kol. Återställd från: chemistry.beloit.edu
- Clark Jim. (2012). Jätte kovalenta strukturer. Återställd från: chemguide.co.uk



Ingen har kommenterat den här artikeln än.