
Bromothymol blå struktur, egenskaper, beredning, användningsområden
De bromotymolblått Det är ett färgämne som är känsligt för pH i omgivningen och har använts som en indikator i många laboratoriereaktioner. En indikator är ett organiskt färgämne vars färg beror på koncentrationen av H-jonen.3ELLER+ eller mediumets pH. På grund av färgen den visar kan indikatorn indikera surhetsgrad eller basitet i lösningen.
Bromotymolblått har en aktiv indikationsskala mellan pH 6,0 och 7,6. Vid ett pH-värde av mediet lägre än 6,5 uppvisar det en gul färg. När mediumets pH varierar mellan 6,5 och 7,6 får det en grön färg. Vid pH över 7,6 är färgen blå.

Denna egenskap gör denna indikator mycket användbar, eftersom den kan användas i en pH-skala nära neutralitet; just där fysiologiska processer förekommer.
Joniseringen av bromtymolblått i vattenlösning kan beskrivas enligt följande:
HIn (gul färg) + HtvåELLER <=> I- (blå färg) + H3ELLER+
När indikatorn är protonerad (HIN) får den en gul färg; medan den deprotonerade indikatorn (In-) blir blått.
Artikelindex
- 1 Kemisk struktur
- 1,1 pH-förändringar
- 2 fastigheter
- 2.1 Kemiskt namn
- 2.2 Molekylformel
- 2.3 Molekylvikt
- 2.4 Fysiskt utseende
- 2.5 Kemisk egenskap
- 2.6 Jonisk dissociationskonstant (Ka)
- 2.7 Aktivt indikationsområde
- 2.8 Densitet
- 2.9 Smältpunkt
- 2.10 Kokpunkt
- 2.11 Löslighet
- 2.12 Stabilitet
- 2.13 Ljusabsorption
- 3 Användningar och applikationer
- 3.1 I metaboliska studier
- 3.2 I obstetrik
- 3.3 Andra användningsområden
- 4 Förberedelse
- 5 Referenser
Kemisk struktur
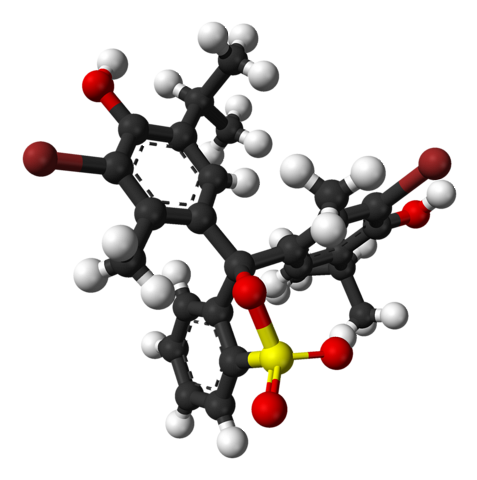
Den övre bilden representerar strukturen för brothymolblått med en stapel- och sfärmodell vid ett pH-värde lägre än 7,1. De bruna staplarna motsvarar bromatomer, två totalt.
Var och en av de tre aromatiska ringarna, tillsammans med metylgrupperna, CH3, och tertbutyl, tymolgruppen; och efter att ha kopplat en Br, uppstår därifrån anledningen till att den kallas "bromotymol".
Längst ner visas sulfonatgruppen, R-SO3-, med röda kulor och en gul. Denna grupp kan kopplas genom en O-atom till det centrala kolet som förenar de tre aromatiska ringarna.
PH ändras
Även om denna molekylära struktur inte förändras radikalt med surt eller basiskt pH, ändras dess elektroniska tillstånd, vilket återspeglas av förändringar i lösningen.
Under pH 7 är indikatorn gul i färg och antar bildens struktur; men om pH blir basiskt kan -OH-grupperna deprotoneras och en C = O-dubbelbindning kan bildas.
Som ett resultat förändras molekylens konjugerade system (det med alla dess resonanta dubbelbindningar) tillräckligt för att elektronerna inte längre absorberar samma fotoner och lösningen blir från gul till blåaktig..
Om pH däremot ligger långt under 7 ändras indikatorns färg från gul till röd. Här beror förändringen i det konjugerade systemet på protoneringen av -OH-grupperna till -OHtvå+. -
I både sura och basiska miljöer tappar molekylen stabilitet och absorberar fotoner med lägre energi för att möjliggöra de elektroniska övergångarna som är ansvariga för de färger som uppfattas av åskådarna..
Och hur är det med den gröna färgen på huvudbilden? När pH närmar sig 7,1 förlorar en liten del av molekylerna protoner, vilket ger en blå färg som, när den blandas med gul, ger färgen grön..
Egenskaper
Kemiskt namn
Bromotymolblått eller 3,3'-dibrometymolsulfonaftalein.
Molekylär formel
C27H28BrtvåELLER5S.
Molekylvikt
624,384 g / mol.
Fysiskt utseende
Fast pulver med en färg som sträcker sig från rosa till lila.
Kemisk egenskap
Det fungerar som en svag syra i lösning. När den protoneras i ett surt medium får den en gul färg, vid neutralt pH är den grön, och när den deprotoneras i ett alkaliskt pH är den blå.
Jonisk dissociationskonstant (Ka)
7,9 x 10-8.
Aktivt indikationsområde
pH 6,0 till 7,6. Detta beror på närvaron av bromatomer som verkar för att extrahera elektroner och två måttliga elektrondonagrupper (alkylsubstituenter).
Densitet
1,25 g / cm3.
Smältpunkt
202 ºC (396 º F).
Kokpunkt
184,9 ºC.
Löslighet
Det är dåligt lösligt i vatten och olja. På samma sätt är den dåligt löslig i icke-polära lösningsmedel såsom bensen, toluen och xylen och praktiskt taget olöslig i petroleumeter. Det är lösligt i vattenhaltiga alkalilösningar och i alkohol.
Stabilitet
Det är stabilt vid rumstemperatur och oförenligt med starka oxidationsmedel.
Ljusabsorption
Den protonerade formen har sin maximala absorption vid en våglängd (λ) på 427 nm, vilket överför gult ljus i syralösningar och den deprotonerade formen har en maximal absorption vid en våglängd (λ) på 602 nm, vilket överför ett blått ljus. Vid alkaliskt pH.
Användningar och applikationer
I metaboliska studier
Bromothymolblått används i många processer där koldioxid (COtvåmed den därav följande genereringen av kolsyra (HtvåCO3som syrnar mediet; framgår av en förändring i färgning av bromotymolblått.
Om en person tränar och är ansluten till ett rör som i sin tur är ansluten till en behållare med en bromotymolblå lösning kommer följande fenomen att observeras: som en konsekvens av ökad fysisk aktivitet och metabolism kommer det att finnas en öka produktionen av COtvå.
Kompaniettvå reagerar med vatten och producerar kolsyra, HtvåCO3, som därefter dissocierar frisättning av H-jon+ och försurande mediet. Som en följd av detta får bromotymolblått en gul färg och markerar mediets surhet..
I obstetrik
Bromothymolblått används i obstetrik för att visa tidigt membranbrott. Fostervätska har normalt ett pH över 7,7, så bromotymolblått blir blått när det kommer i kontakt med vätskan som läcker från amnion..
Vaginalt pH är vanligtvis surt, så bromotymolblått har en gul nyans. Förändringen i dess färg till blå belyser förekomsten av fostervätska i vaginalområdet.
Andra användningsområden
Bromothymol blue har också tillämpning i följande utrustning och funktioner:
-Optiska sensorer
-System för upptäckt av gasförbränning
-Vid tillverkning av färger, leksaker, rengöringsprodukter, rengöringsmedel och textilier
-Sensorer för matens färskhet
-Som ett handtag för färskt och inaktuellt ris
-Vid upptäckt av mikroorganismer.
Det används också i bakterietillväxtanalys, psykoaktiva läkemedel och tandmaterial..
Förberedelse
100 mg bromotymolblått löses i 100 ml utspädd alkohol och filtreras vid behov. Det framställs också enligt följande: 50 mg bromotymolblått löses i en blandning av 4 ml 0,02 N natriumhydroxid och 20 ml alkohol, vilket ger upp till 100 ml med vatten.
Referenser
- Wikipedia. (2018). Bromotymolblått. Återställd från: en.wikipedia.org
- Foist L. (2018). Bromothymolblå: definition, användningsområden och formel. Studie. Återställd från: study.com
- Science Company. (2018). Bromothymol Blue pH-indikator, 1 oz. Återställd från: sciencecompany.com
- Spektrofotometrisk bestämning av pK för bromotymolblå indikator. Återställd från: fch.upol.cz
- PubChem. (2018). Bromothymol Blue. Återställd från: pubchem.ncbi.nlm.nih.gov
- Royal Society of Chemistry. (2015). Bromotymolblått. ChemSpider. Återställd från: chemspider.com
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan). CENGAGE Learning.


Ingen har kommenterat den här artikeln än.