
Beryllium historia, struktur, egenskaper, användningsområden
De beryllium Det är ett metallelement som tillhör grupp 2 eller IIA i det periodiska systemet. Det är den lättaste jordalkalimetallen i gruppen och representeras av symbolen Be. Dess atom och katjon är också mindre än dess kongeners (Mg, Ca, Sr ...).
På grund av dess ovanliga laddningstäthet förekommer denna metall vanligtvis inte isolerat. Cirka 30 mineraler är kända för att innehålla det, bland annat: beryl (3BeOAltvåELLER36SiOtvå2HtvåO), bertrandit (4BeO.2SiOtvå.2HtvåO), krysoberyl (BeAltvåELLER4) och fenaquita (BetvåJa4).

Smaragd, en ädelsten, är en variant av beryl. Men rent beryllium är inte så slående; den har blekgråglans (toppbild) och har uppnåtts i form av frön eller pastiller.
Beryllium har en uppsättning karakteristiska fysiska egenskaper. Den har låg densitet; höga termiska och elektriska ledningar, liksom dess värmekapacitet och värmeavledning; det är inte en magnetisk metall; och har också en lämplig kombination av stelhet och elasticitet.
Alla dessa egenskaper har lett till att beryllium är en metall med många applikationer, allt från dess användning i legeringar med koppar för tillverkning av verktyg, till dess användning i raketer, flygplan, bilar, kärnreaktorer, röntgenutrustning, resonans kärnmagnetisk, etc.
Beryllium har 10 kända isotoper, allt från 5Var en 14Var, vara 9Var den enda stabila. På samma sätt är det en mycket giftig metall, som särskilt påverkar andningsorganen, så det finns en begränsning i dess användning..
Artikelindex
- 1 Historia av dess upptäckt
- 2 Berylliums struktur
- 3 Elektronisk konfiguration
- 4 fastigheter
- 4.1 Fysisk beskrivning
- 4.2 Smältpunkt
- 4.3 Kokpunkt
- 4.4 Densitet
- 4.5 Atomradie
- 4.6 Kovalent radie
- 4.7 Atomvolym
- 4.8 Specifik värme
- 4.9 Fusionsvärme
- 4.10 Avdunstningsvärme
- 4.11 Elektronegativitet
- 4.12 Standardpotential
- 4.13 Ljudets hastighet
- 4.14 Värmeutvidgning
- 4.15 Värmeledningsförmåga
- 4.16 Kemiska egenskaper
- 5 applikationer
- 5.1 Utveckling av verktyg
- 5.2 Att göra speglar
- 5.3 Vid joniserande strålning
- 5.4 I magnetismgenererande utrustning
- 5.5 Kärnreaktorer
- 5.6 Metallskydd
- 6 Var är?
- 7 risker
- 8 Referenser
Historien om dess upptäckt
Beryllium upptäcktes av Louis-Nicolas Vauguelin 1798 som ett sammansättningselement av mineralet beryl och ett silikat av aluminium och beryllium.
Senare lyckades den tyska kemisten Frederic Wöhler, 1828, att isolera beryllium genom att reagera kalium med berylliumklorid i en platina degel..
Samtidigt och oberoende uppnådde den franska kemisten Antoine Bussy också isoleringen av beryllium. Wöhler var den första som föreslog namnet beryllium för metallen.
Det fick sitt nuvarande namn 1957, eftersom det tidigare var känt som glukinium på grund av den söta smaken av några av dess salter. Men för att undvika förvirring med andra sötsmakande föreningar och med en växt som heter glukin, beslutades det att byta namn till beryllium..
Berylliums struktur
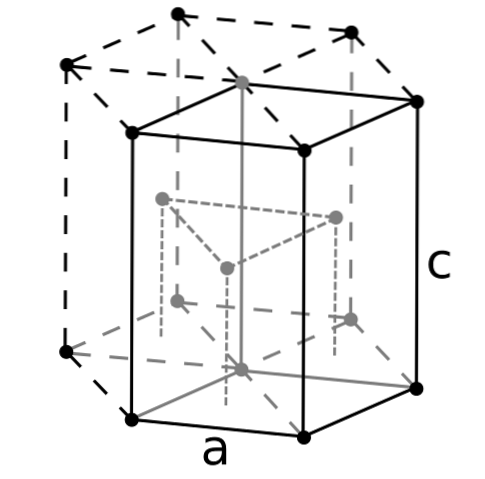
Beryllium är den lättaste av jordalkalimetallerna, och dess atomer bör förväntas vara den minsta av alla. Berylliumatomer interagerar med varandra genom metallbindningen, på ett sådant sätt att deras "hav av elektroner" och avstötningarna mellan kärnorna formar strukturen för den resulterande kristallen..
De svarta kristallerna av beryllium bildas sedan. Dessa kristaller har en sexkantig struktur (övre bild), där varje Be-atom har sex sidogrannar och ytterligare tre i planen ovan och under..
Eftersom kristallerna är svarta är det bra att föreställa sig att de svarta punkterna i den sexkantiga strukturen ersätts av berylliumatomer. Detta är en av de mest kompakta strukturerna som en metall kan använda; och det är vettigt att de mycket små atomerna i Be "pressas" så mycket för att undvika minsta möjliga tomrum eller antal hål mellan dem.
Elektronisk konfiguration
1stvå2stvå
Vilket är lika med 4 elektroner, varav 2 har valens. Om en elektron befordras till 2p-banan kommer vi att ha två sp hybridorbitaler. Således kan det i berylliumföreningar finnas linjära geometrier, X-Be-X; till exempel den isolerade molekylen av BeCltvå, Cl-Be-Cl.
Egenskaper
Fysisk beskrivning
Blankt, sprött, stålgrått fast ämne.
Smältpunkt
1287 ºC.
Kokpunkt
2471 ºC.
Densitet
- 1,848 g / cm3 vid rumstemperatur.
- 1,69 g / cm3 till smältpunkt (flytande tillstånd).
Atomradio
112.00.
Kovalent radie
90.00.
Atomvolym
5 cm3/ mol.
Specifik värme
1824 J / gmol vid 20 ºC.
Fusionsvärme
12,21 kJ / mol.
Avdunstningsvärme
309 kJ / mol.
Elektronnegativitet
1,57 på Pauling-skalan.
Standardpotential
1,70 V.
Ljudets hastighet
12.890 m / s.
Termisk expansion
11,3 µm / m K vid 25 ºC.
Värmeledningsförmåga
200 w / m K.
Kemiska egenskaper
Beryllium är belagt med ett lager av berylliumoxid (BeO) som skyddar det i luft vid rumstemperatur. Oxidationen av beryllium sker vid temperaturer över 1000 ºC, med ursprung som produkter berylliumoxid och berylliumnitrid.
Det är också motståndskraftigt mot verkan av salpetersyra 15 M. Men det löser sig i saltsyra och alkalier, såsom natriumhydroxid..
Applikationer
Verktygstillverkning
Beryllium bildar legeringar med koppar, nickel och aluminium. I synnerhet producerar legeringen med koppar verktyg med stor hårdhet och motståndskraft och utgör endast 2% av legeringens vikt..
Dessa verktyg producerar inte gnistor när de slår på järn, vilket gör att de kan användas i miljöer med högt innehåll av brännbara gaser..
På grund av dess låga densitet har den en låg vikt, som tillsammans med sin styvhet tillåter användning i rymdflygplan, raketer, missiler och flygplan. Legeringen med beryllium har använts vid tillverkning av bildelar. Det har också använts vid produktion av fjädrar.
På grund av den stora hårdheten som beryllium ger sina legeringar har de använts i bromsarna på militära flygplan.
Spegling
Beryllium har använts i produktionen av speglar på grund av dess dimensionella stabilitet och dess förmåga att vara mycket polerad. Dessa speglar används i satelliter och i brandkontrollsystem. Dessutom används de i rymdteleskop.
I joniserande strålning
Beryllium är ett element med låg densitet, så det kan anses vara transparent för röntgenstrålar.Denna egenskap möjliggör dess användning vid konstruktionen av fönstren på rören som producerar röntgenstrålar, för industriell användning och för medicinsk diagnos..
Beryllium används också i fönstren hos radioaktiva utsläppsdetektorer..
I magnetismgenererande utrustning
Bland egenskaperna hos beryllium är att det inte är ett magnetiskt element. Detta gör det möjligt att använda den vid konstruktionen av artiklar av magnetisk resonansutrustning, där magnetfält med hög intensitet genereras, vilket minimerar eventuella störningar.
Kärnreaktorer
På grund av dess höga smältpunkt har den funnit tillämpning i kärnreaktorer och keramer. Beryllium används som moderator för kärnreaktioner och som producent av neutroner:
9Vara + 4Han (α) => 12C + n (neutron)
Det uppskattas att upp till 30 miljoner neutroner produceras för en miljon berylliumatomer som bombarderas med α-partiklar. Just denna kärnreaktion möjliggjorde upptäckten av neutronen.
James Chadwick bombade berylliumatomer med α (He) -partiklar. Forskaren observerade frisättningen av subatomära partiklar, utan elektrisk laddning, vilket ledde till upptäckten av neutroner.
Metallskydd
Att lägga till en mängd beryllium på ytan av metaller som kan oxideras ger dem ett visst skydd. Exempelvis reduceras antändligheten hos magnesium och glansen hos silverlegeringar förlängs.
Var finns den?
Beryl finns i pegmatit, associerat med glimmer, fältspat och kvarts. Genom att använda en flotationsteknik separeras en blandning av beryl och fältspat. Därefter koncentreras fältspat och beryl och behandlas med kalciumhypoklorit..
Följt av en behandling med svavelsyra och kaliumsulfonat, genom en utspädning, uppnås flytningen av beryl och separerar den från fältspat.
Beryl behandlas med natriumfluorsilikat och läsk vid 770 ° C för att bilda natriumfluorobylat, aluminiumoxid och kiseldioxid. Berylliumhydroxid fälls sedan ut från natriumfluoroberylatlösningen med natriumhydroxid.
Berylliumfluorid bildas genom att reagera berylliumhydroxid med ammoniakvätefluorid, vilket ger ammoniumtetrafluroberylat. Denna värms upp för att bilda berylliumfluorid, som varmbehandlas med magnesium för att isolera berylliumet..
Risker
Beryllium som finfördelad metall, i form av lösningar, torrt pulver eller rök, är mycket giftigt och kan orsaka dermatit. Den största toxiciteten produceras dock genom inandning.
Inledningsvis kan beryllium framkalla en överkänslighet eller allergi, som kan utvecklas till beryllios eller kronisk berylliumsjukdom (CBD). Detta är en allvarlig sjukdom som kännetecknas av en minskad lungkapacitet.
Akut sjukdom är sällsynt. Vid kronisk sjukdom bildas granulom i hela kroppen, särskilt i lungorna. Kronisk beryllios orsakar progressiv dyspné, hosta och allmän svaghet (asteni).
Akut beryllios kan vara dödlig. I beryllios inträffar den gradvisa förlusten av andningsfunktionen, eftersom det finns hinder i gasflödet i luftvägarna och minskad syresättning av arteriellt blod.
Referenser
- Royal Society of Chemistry. (2019). Beryllium. Återställd från: rsc.org
- Nationellt centrum för bioteknikinformation. (2019). Beryllium. PubChem-databas. Återställd från: pubchem.ncbi.nlm.nih.gov
- Helmenstine, Anne Marie, Ph.D. (15 mars 2019). Beryllium Fakta. Återställd från: thoughtco.com
- Wikipedia. (2019). Beryllium. Återställd från: en.wikipedia.org
- Lenntech B. V. (2019). Beryllium-Be. Återställd från: lenntech.com
- Materio Corporation. (2019). Lär dig mer om elementet beryllium Återställs från: beryllium.com
- D. Michaud. (2016, 12 april). Beryllium bearbetning & utvinning problem. 911 Metallurg. Återställd från: 911metallurgist.com
- Timothy P. Hanusa. (5 januari 2016). Beryllium. Encyclopædia Britannica. Återställd från: britannica.com
- Lee S. Newman. (2014). Berylliumsjukdom. MSD Manual. Återställd från: msdmanuals.com



Ingen har kommenterat den här artikeln än.