
Natriumborhydrid (NaBH4) struktur, egenskaper, användningsområden

De natriumborhydrid är ett oorganiskt fast ämne vars kemiska formel är NaBH4. Det kan anses vara representativt för alkaliborhydriderna och är det vanligaste av dessa. Det är ett vitt kristallint fast ämne.
Vid kontakt med vatten, NaBH4 kan generera värme och väte Htvå som är brännbart, så det måste hanteras med försiktighet. På grund av den lätthet med vilken det kan generera hydridjoner H-, natriumborhydrid är en måttligt reducerande förening, så den används ofta i kemiska reaktioner för detta ändamål.

Dess reducerande egenskap används också i pappersindustrin, eftersom det förbättrar massa och pappers ljusstyrka och stabilitet genom att motverka oxidationen av cellulosa, huvudkomponenten i papper..
Eftersom det lätt kan bilda väte i närvaro av vatten har också möjligheten att använda det som en reversibel vätekälla i bränsleceller undersökts..
Det har andra användningsområden alla baserade på dess reducerande egendom, såsom i läkemedelsindustrin.
Artikelindex
- 1 Struktur
- 2 Nomenklatur
- 3 Fysiska egenskaper
- 3.1 Fysiskt tillstånd
- 3.2 Molekylvikt
- 3.3 Självantändningstemperatur
- 3.4 Sönderfallstemperatur
- 3.5 Densitet
- 3.6 Löslighet
- 4 Kemiska egenskaper
- 5 risker
- 6 Erhåller
- 7 användningsområden
- 7.1 Vid reduktion av kemiska reaktioner
- 7.2 Vid produktion av H2 i bränsleceller
- 7.3 Inom massa- och pappersindustrin
- 7.4 I olika användningsområden
- 8 Referenser
Strukturera
Natriumborhydrid är en jonförening. Den bildas av borhydridanjonen [BH4]- fäst till natriumkatjonen Na+.
Anjonen [BH4]- är tetrahedral.
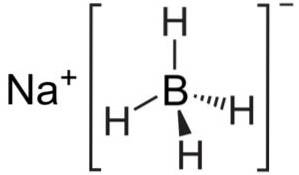
Dess Lewis-struktur är som följer:
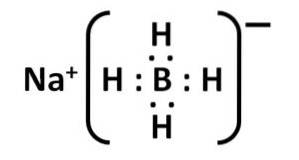
Nomenklatur
-Natriumborhydrid
-Natriumtetrahydroborat
-Natriumtetrahydruroborat
Fysikaliska egenskaper
Fysiskt tillstånd
Fast vit kristallin.
Molekylvikt
37,84 g / mol
Självantändningstemperatur
∼ 220 ºC
Sönderfallstemperatur
> 250 ºC
Densitet
1,074 g / cm3 vid 20 ºC
Löslighet
NaBH4 det är ganska lösligt i vatten (55 g / 100 ml vid 25 ºC), där det delvis hydrolyseras. Det är lösligt i tetrahydrofuran (THF) och är olösligt i dietyleter.
Kemiska egenskaper
Natriumborhydrid löses upp i vatten, där den genomgår sönderdelning eller hydrolys som gör lösningen basisk, vilket förhindrar ytterligare hydrolys..
[BH4]- + HtvåO → B (OH)3 + Htvå↑ + OH-
Detta förklaras eftersom [BH4]- interagerar med H+ av vattnet, där H+ tar en hydridanjon H- för att bilda Htvå. Det kan sägas att BH3 tävla med H+ av hydridjonen H-.
I ett surt medium är hydrolysen fullständig på grund av överflödet av H-joner+.
NaBH4 den är stabil i torr luft. Det är inte flyktigt.
På grund av dess innehåll av hydridjoner är natriumborhydrid en reducerande förening. Det gör det möjligt att reducera karbonylgruppen C = O till C-OH, det vill säga karbonylföreningar till alkoholer.
NaBH4 I sig själv reducerar det inte C = C dubbelbindningar, inte ens de konjugerade med karbonylgrupper -C = C-C (= O)-.
Men vid kontakt med protonsyror (såsom HCl) eller Lewis-syror (såsom BCl3 eller AlCl3diboran B bildastvåH6. Och om denna reaktion utförs i närvaro av organiska föreningar med C = C dubbelbindningar, diboran B.tvåH6 utför hydroboration av dessa.
I närvaro av lämpliga katalysatorer och specifika betingelser kan natriumborhydrid reducera olika typer av funktionella grupper.
Risker
Värmen från hydrolysreaktionen i vatten är tillräcklig för att antända väte som bildas i den. Så det är viktigt att vara försiktig när du hanterar den.
NaBH4 det antänds lätt och brinner lätt.
Erhållande
Den typiska NaBH-beredningsreaktionen4 är genom natriumhydrid NaH och B (OCH3)3 vid en temperatur av cirka 250 ºC:
4 NaH + B (OCH3)3 → NaBH4 + 3 NaOCH3
Applikationer
Vid minskning av kemiska reaktioner
Eftersom det är en källa till H-joner-, NaBH4 Det är en reducerande förening och används för att bereda andra kemiska föreningar. För detta används den i aprotiska polära lösningsmedel, det vill säga utan H-protoner+, såsom dimetylsulfoxid, hexametylfosforamid och dimetylformamid.
Det används som reduktionsmedel i både organiska och oorganiska kemiska reaktioner..
Det gör det möjligt att reducera aldehyder till primära alkoholer och ketoner till sekundära alkoholer.
Det reducerar också alkylhalogenider till kolväten såsom jododekan till dekan, bromoundekansyra till undekansyra och klordodekan till dodekan..
Om det verkar ensamt påverkar det inte andra funktionella grupper som ester, karboxylsyra, nitril och sulfon när reduktionen utförs.
Dess egenskap att inte reducera C = C dubbelbindningar, inte ens de konjugerade med karbonylgrupper -C = C-C (= O) -, gör det möjligt att framställa omättade alkoholer -C = C-CHtvå-Åh.
För att reducera nitrerade aromatiska föreningar till motsvarande aniliner krävs närvaron av katalysatorer såsom kobolt eller tennklorid. Minskar disulfider till tioler.
I närvaro av lämpliga betingelser och katalysatorer tillåter det att reducera karboxylsyror, estrar, amider, nitriler, iminer, epoxider och till och med dubbel- och trippelbindningar.
I produktionen av Htvå i bränsleceller
NaBH4 kan omvandlas till en bränslecell.
NaBH4 i närvaro av en alkalisk lösning av KOH eller NaOH hydrolyserar den och producerar väte Htvå som kan användas som bränsle i en polymerelektrolytbränslecell.
Det har också undersökts som ett lagringsmaterial för Htvå vändbart.
NaBH-nanopartiklar syntetiseras4 och stabiliserades med ett ytaktivt medel. Efter behandling med NiCltvå ett skyddande skikt eller beläggning bildas som reglerar frisättningen av Htvå helt vändbar.
Detta nya nanometriska material möjliggör användning av Htvå som ett rent och förnybart bränsle.

Inom massa- och pappersindustrin
Natriumborhydrid används för att förbättra glans och andra fysikaliska egenskaper hos massa och papper..
Nedbrytningen av cellulosamatrisen i papperet sker genom komplexa processer som involverar oxidation. Hydroxylgrupper oxideras till karbonyl och karboxyl, vilket leder till missfärgning av papperet och en minskning av dess fysikaliska egenskaper..
Vid behandling av massa eller papper med NaBH4, Detta reducerar aldehyder och ketoner till -OH-grupper utan att påverka de sura karboxylgrupperna, vilket förbättrar stabiliteten och glansen vid högre än initialvärden..

I olika användningsområden
Natriumborhydrid används för att behandla avloppsvatten, som ett smakförbättrande medel inom livsmedels- och dryckesindustrin, som beläggningsmedel och för ytbehandling, vid tobaksproduktion, inom läkemedels-, textil- och industriindustrin..
Referenser
- Christian, M.L. och Aguey-Zinsou, K.-F. (2012). Core-Shell-strategi som leder till hög reversibel vätgaslagringskapacitet för NaBH4. ACS Nano 2012, 6, 9, 7739-7751. Återställd från pubs.acs.org.
- Nora de Souza, M.V. och Alves V., T.R. (2006). Nya metoder förmedlade av natriumborhydrid vid reduktion av olika klasser av föreningar. App Organometal. Chem. 2006; 20: 798-810. Återställd från onlinelibrary.wiley.com.
- Imamoto, T. (1991). Minskning. Natriumborhydrid. I omfattande organisk syntes. Återställd från sciencedirect.com.
- Tang, L.C. (1986) Stabilisering av papper genom natriumborhydridbehandling. I historiska textil- och pappersmaterial. Kapitel 24. Sidorna 427-441. Framsteg inom kemi, volym 212. Återställd från pubs.acs.org.
- Cotton, F. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- Morrison, Robert Thornton; och Boyd, Robert Neilson. 1992. Organisk kemi. Prentice-Hall. ISBN 81-203-0765-8.
- USA National Library of Medicine. (2019). Natriumborhydrid. Återställd från: pubchem.ncbi.nlm.nih.gov.


Ingen har kommenterat den här artikeln än.