
Värmekänsligt koncept, formler och lösta övningar
De kännbart värme är den värmeenergi som tillförs ett objekt som får det att öka temperaturen. Det är motsatsen till latent värme, där termisk energi inte ökar temperaturen utan främjar en fasförändring, till exempel från fast till vätska..
Ett exempel klargör begreppet. Anta att vi har en kruka med vatten vid en rumstemperatur på 20 ° C. När vi placerar den på kaminen ökar den tillförda värmen långsamt vattentemperaturen tills den når 100 ° C (koktemperaturen vid havet). Den tillförda värmen kallas förnuftig värme.

När vattnet når kokpunkten höjer inte värmen från brännaren vattentemperaturen, som förblir vid 100 ° C. I detta fall investeras den tillförda termiska energin i att avdunsta vattnet. Den tillförda värmen är latent eftersom den inte höjde temperaturen utan istället orsakade en förändring från vätskefasen till gasfasen.
Det är ett experimentellt faktum att den känsliga värmen som krävs för att uppnå en viss temperaturvariation är direkt proportionell mot den variationen och objektets massa..
Artikelindex
- 1 Koncept och formler
- 1.1 Den adiabatiska koefficienten γ
- 1.2 Värmekapacitet C
- 1.3 Specifik värme i fasta ämnen, vätskor och gaser
- 2 Skillnad med latent värme
- 2.1 Hur man beräknar latent värme?
- 3 Lösta övningar
- 3.1 Exempel 1
- 3.2 Exempel 2
- 3.3 Exempel 3
- 4 Referenser
Koncept och formler
Det har observerats att förutom massan och temperaturskillnaden beror den känsliga värmen också på materialet. Av denna anledning kallas proportionalitetskonstanten mellan känslig värme och massprodukten och temperaturskillnaden specifik värme.
Mängden tillförd känslig värme beror också på hur processen utförs. Till exempel är det annorlunda om processen utförs vid konstant volym än vid konstant tryck.
Formeln för förnuftig värme i en process isobarisk, det vill säga vid konstant tryck är det följande:
Q = cp . m (TF - Ti)
I ovanstående ekvation F är den förnuftiga värmen som tillförs massobjektet m, som har höjt sin initialtemperatur Ti tills det slutliga värdet Tf. I ovanstående ekvation visas det också csid, vilket är materialets specifika värme vid konstant tryck eftersom processen har utförts på detta sätt.
Observera också att känslig värme är positiv när den absorberas av objektet och orsakar en temperaturökning..
I det fall värme tillförs en gas innesluten i en styv behållare kommer processen att ske isokorisk, det vill säga vid konstant volym; och formeln för förnuftig värme kommer att skrivas så här:
Q = cv. m. (TF - Ti)
Den adiabatiska koefficienten γ
Kvoten mellan den specifika värmen vid konstant tryck och den specifika värmen vid konstant volym för samma material eller substans kallas adiabatisk koefficient, vilket vanligtvis betecknas med den grekiska bokstaven gamma γ.
De adiabatisk koefficient är större än enhet. Värmen som krävs för att höja temperaturen på en kropp med ett gram massa med en grad är större i en isobar process än i en isokorisk..
Detta beror på att i det första fallet används en del av värmen för att utföra mekaniskt arbete.
Förutom specifik värme definieras ofta en kropps värmekapacitet. Detta är den mängd värme som krävs för att höja kroppens temperatur en grad Celsius.
Värmekapacitet C
Värmekapacitet betecknas med C versaler, medan den specifika värmen med c små bokstäver. Förhållandet mellan båda mängderna är:
C = c ^ m
Var m är kroppens massa.
Molarspecifik värme används också, vilket definieras som den mängd känslig värme som krävs för att höja temperaturen på en mol substans med en grad Celsius eller Kelvin..
Specifik värme i fasta ämnen, vätskor och gaser
Den molära specifika värmen för de flesta fasta ämnen har ett värde nära 3 gånger R, var R är den universella gaskonstanten. R = 8,314472 J / (mol ℃).
Till exempel har aluminium molär specifik värme 24,2 J / (mol ℃), Koppar 24,5 J / (mol ℃), guld- 25,4 J / (mol ℃), och det söta järnet 25,1 J / (mol ℃). Observera att dessa värden är nära 3R = 24,9 J / (mol ℃).
Däremot är den molära specifika värmen för de flesta gaser nära n (R / 2), var är n ett heltal och R är den universella gaskonstanten. Hela numret n är relaterat till antalet frihetsgrader för molekylen som utgör gasen.
Till exempel, i en monatomisk idealgas, vars molekyl bara har de tre translationella frihetsgraderna, är den molära specifika värmen vid konstant volym 3 (R / 2). Men om det är en diatomisk idealgas finns det dessutom två rotationsgrader, så cv = 5 (R / 2).
I ideala gaser gäller följande förhållande mellan molär specifik värme vid konstant tryck och konstant volym: csid = cv + R.
Särskilt omnämnande förtjänar vattnet. I flytande tillstånd vid 25 ℃ har vattnet csid = 4,1813 J / (g ℃), vattenånga vid 100 grader Celsius csid = 2080 J / (g ℃) och isvatten vid noll grad celsius har csid = 2050 J / (g ℃).
Skillnad med latent värme
Materien kan finnas i tre tillstånd: fast, flytande och gas. Energi krävs för att ändra tillstånd, men varje ämne reagerar på det på olika sätt beroende på dess molekylära och atomiska egenskaper..
När ett fast ämne smälter eller en vätska avdunstar förblir föremålets temperatur konstant tills alla partiklar har ändrat sitt tillstånd..
Av denna anledning är det möjligt för ett ämne att vara i jämvikt i två faser: fast - flytande eller flytande - ånga, till exempel. En mängd av ämnet kan passera från ett tillstånd till ett annat genom att tillsätta eller ta bort lite värme, medan temperaturen förblir fast..
Värmen som tillförs ett material får partiklarna att vibrera snabbare och öka sin kinetiska energi. Detta innebär en temperaturökning.
Det är möjligt att energin de förvärvar är så stor att de inte längre återgår till sin jämviktsposition och separationen mellan dem ökar. När detta händer ökar inte temperaturen, men ämnet går från fast till flytande eller från vätska till gas.
Den värme som krävs för att detta ska ske är känd som latent värme. Därför är latent värme värmen genom vilken ett ämne kan ändra fas.
Här är skillnaden med förnuftig värme. Ett ämne som absorberar känslig värme ökar temperaturen och förblir i samma tillstånd.
Hur man beräknar latent värme?
Latent värme beräknas med ekvationen:
Q = m. L
Var L det kan vara den specifika förångningsvärmen eller fusionsvärmen. Enheterna i L är energi / massa.
Forskare har gett värme många namn, beroende på vilken typ av reaktion den deltar i. Det finns till exempel reaktionsvärme, förbränningsvärme, stelningsvärme, lösningsvärme, sublimeringsvärme och många andra..
Värdena för många av dessa värmetyper för olika ämnen tabelleras.
Lösta övningar
Exempel 1
Anta en som har en bit aluminium med en vikt på 3 kg. Ursprungligen är den vid 20 ° C och du vill höja temperaturen till 100 ° C. Beräkna den känsliga värmen som krävs.
Lösning
Först måste vi känna till den specifika värmen hos aluminium
csid = 0,897 J / (g ° C)
Då blir mängden värme som behövs för att värma aluminiumbiten
Q = csid m (Tf - Ti) = 0,897 * 3000 * (100 - 20) J
Q = 215 280 J
Exempel 2
Beräkna mängden värme som krävs för att värma 1 liter vatten från 25 ° C till 100 ° C vid havsnivå. Uttrycka resultatet också i kilokalorier.
Lösning
Det första du måste komma ihåg är att 1 liter vatten väger 1 kg, det vill säga 1000 gram.
Q = csid m (Tf - Ti) = 4,1813 J / (g ℃) * 1000 g * (100 ℃ - 25 ℃) = 313597,5 J
Kalorin är en energienhet som definieras som den känsliga värme som krävs för att höja ett gram vatten med en grad Celsius. Därför motsvarar 1 kalori 4,1813 Joule.
Q = 313597,5 J * (1 kal / 4,1813 J) = 75000 kal = 75 kcal.
Exempel 3
En 360,16 g materialstycke värms upp från 37 ℃ till 140 ℃. Den levererade termiska energin är 1150 kalorier.
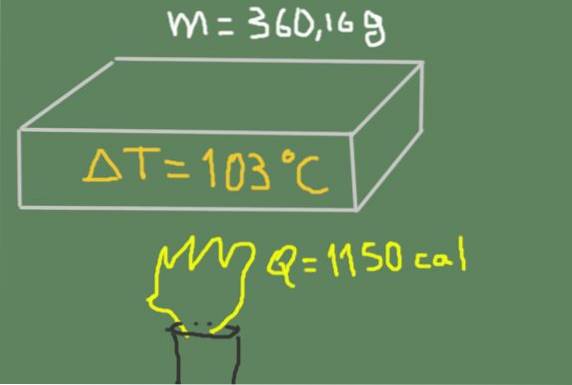
Hitta materialets specifika värme.
Lösning
Vi kan skriva den specifika värmen som en funktion av den känsliga värmen, massan och temperaturvariationen enligt formeln:
csid = Q / (m AT)
Att ersätta uppgifterna har vi följande:
csid = 1150 cal / (360,16 g * (140 ℃ - 37 ℃)) = 0,0310 cal / (g ℃)
Men eftersom en kalori är lika med 4,1813 J kan resultatet också uttryckas som
csid = 0,130 J / (g ℃)
Referenser
- Giancoli, D. 2006. Fysik: principer med tillämpningar. 6th. Ed Prentice Hall. 400 - 410.
- Kirkpatrick, L. 2007. Fysik: En titt på världen. 6ta Förkortad upplaga. Cengage Learning. 156 - 164.
- Tippens, P. 2011. Fysik: begrepp och tillämpningar. 7: e. Reviderad upplaga. McGraw Hill. 350 - 368.
- Rex, A. 2011. Grundläggande fysik. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Universitetsfysik med modern fysik. 14th. Volym 1. 556 - 553.
- Serway, R., Vulle, C. 2011. Fundamentals of Physics. 9na Cengage Learning. 362 - 374.



Ingen har kommenterat den här artikeln än.