
Kännetecken för syror och baser

Syrorna och basernas egenskaper är alla de egenskaper och kvaliteter som vi kan skilja mellan en syra och en bas med..
Enligt Arrehnius teori, a syra är ett ämne som frigör protoner H+ vid upplösning i vatten, och bas är något ämne som frigör hydroxyljoner OH- i vattenlösning.
| Syror | Baser | |
|---|---|---|
| Jonbildning | Närvarande | Närvarande |
| Neutraliseringsreaktion | När du reagerar med en bas. | När det reagerar med en syra. |
| Vattenlöslighet | Löslig | Delvis löslig. Kalcium-, barium- och aluminiumhydroxider är dåligt lösliga. |
| Elektrisk ledningsförmåga | Närvarande | Närvarande |
| Ärendets tillstånd | Fast, flytande eller gasformigt | Fast, flytande eller gasformigt |
| Reaktion med lakmuspapper | Röd färg | Blå färg |
| PH värde | Under 7 | Mer än 7 |
| Konjugerad motsvarighet | En svag syra bildar en konjugatbas. | En svag bas bildar en konjugerad syra. |
| Frätande effekt | Starka syror | Starka baser |
Kännetecken för syror
Syror har flera egenskaper som de kan identifieras med.
Förmåga att bilda joner från syror
De huvudsakliga egenskaperna hos sura ämnen är att de kan joniseras, det vill säga förlora eller få elektroner.
Saltsyra HCl, en stark syra, joniseras för att bilda kloridanjon Cl- och proton H+.
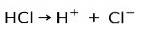
Neutraliseringsreaktion
En syra reagerar med en bas för att bilda ett salt och vatten. Denna reaktion är känd som neutraliseringsreaktion. Exempelvis reagerar HCl med NaOH för att bilda natriumklorid NaCl (köksalt) och vatten:
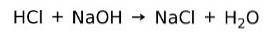
Vattenlöslighet i syror
Syror är i allmänhet lösliga i vatten. Till exempel är saltsyra eller muriatsyra måttligt löslig i vatten, upp till 82 g HCl kan lösas i 100 ml vatten vid 0 ° C. När det gäller svavelsyra HtvåSW4, blandning med vatten genererar värme, så det är alltid lämpligt att tillsätta syran i vattnet för att undvika explosioner.
Syrahållfasthet
Hur syror dissocierar avgör om de är starka eller svaga. Styrkan hos en syra ges av dess dissociationskonstant.
Salpetersyra HNO3 det är en stark syra eftersom det i vattenlösning helt joniseras till protoner och nitratjoner:
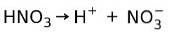
Det betyder att när vi lägger till HNO3 i vatten, när vi analyserar vattnet hittar vi bara H+ och nitratjoner och praktiskt taget inget HNO3.
Istället är ättiksyra som finns i ättika a svag syra, eftersom bara en del av det är dissocierat:
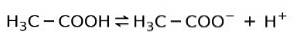
Det är därför det representeras med pilar i två riktningar, det betyder att i vattenlösning kommer vi att ha ättiksyra, H+ och acetatanjonen (H3C-COO-).
Tillstånd av syror
Syror finns i flytande, fast eller gasformigt tillstånd. Till exempel är saltsyra-HCl flytande, vätesulfid HS är en gas och oxalsyra är ett fast ämne..
Reaktion med lakmuspapper från syror

När vi lägger en remsa med lakmuspapper i en sur substans blir lakmuspapperet rött.
Identifiering av syror genom deras pH
PH är måttet på mängden H+ närvarande i en lösning. Således är vi mellan pH 0 och 7 i närvaro av en syra. Till exempel har vinäger ett pH som är lika med 2, svavelsyrans pH i bilbatterier är lika med 1.
Elektrisk ledningsförmåga hos syror
Eftersom syror kan lossna och producera elektriskt laddade joner kan sura lösningar leda elektricitet. Inom bilbatterier används till exempel svavelsyra, som är en stark syra som ledare för el..
Frätande effekt av starka syror
Starka syror har en frätande effekt, de kan bränna organiska vävnader så deras hantering måste vara extremt försiktig.
Svaga syror bildar en konjugerad motsvarighet
Svaga syror när de är upplösta bildar det som kallas ett konjugatpar, det vill säga en svag syra bildar en konjugatbas.
Till exempel:
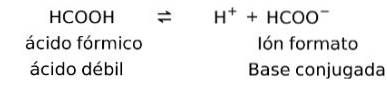
I detta fall bildar myrsyra eller metansyra (HCOOH), när den dissocieras, det konjugerade basjonformatet.
Det kan intressera dig:
- Starka och svaga syror och baser.
- Exempel på syror och baser.
Basens egenskaper
Därefter presenterar vi egenskaperna hos baserna eller de alkaliska lösningarna som kännetecknar dem.
Basjoniseringskapacitet
Basiska eller alkaliska ämnen kännetecknas av att de bildar joner när de löses i vatten:
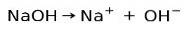
I detta fall joniserar natriumhydroxiden NaOH för att bilda en hydroxidanjon OH- och en natriumkation Na+.
En bas reagerar med en syra för att bilda ett salt
En bas reagerar med en syra i en neutraliseringsreaktion för att bilda vatten och ett salt, till exempel:
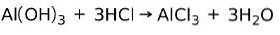
I detta fall är aluminiumhydroxiden Al (OH)3, en bas, reagerar med HCl och bildar aluminiumkloridsaltet AlCl3 och vatten. Aluminiumhydroxid används som ett antacida för att lindra gastrisk återflöde genom att neutralisera syran som produceras i magen.
Baserar vattenlöslighet
Vissa baser är lösliga i vatten. Jordalkaliska hydroxider, såsom kalciumhydroxid och bariumhydroxid, är dåligt lösliga i vatten. Exempelvis kan natriumhydroxid eller kaustisk soda lösas 109 g i 100 ml vatten vid 20 ° C. Medan magnesiumhydroxid eller mjölk av magnesia Mg (OH)två är praktiskt taget olösligt i vatten.
Basstyrka
Beroende på basens joniseringsgrad kan dessa vara starka eller svaga. Till exempel är litiumhydroxid a stark bas eftersom det i vattenlösning helt joniseras till hydroxidjoner OH och litium Li-katjoner+:
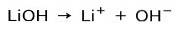
Å andra sidan ammoniak NH3 är en svag bas för när det kommer i kontakt med vatten, dissocierar inte all ammoniak:
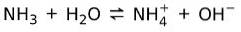
Grundtillstånd för materien
Baser finns i fasta, flytande och gasformiga tillstånd. Till exempel är ren natriumhydroxid fast, ammoniak är en gas.
Reaktion med basens lakmuspapper
När vi lägger en remsa med lakmuspapper i en alkalisk substans blir papperet blått.
Identifiering av baser genom deras pH
Baserna kännetecknas av att de har ett pH mellan 7 och 14.
 Basens elektriska ledningsförmåga
Basens elektriska ledningsförmåga
Baserna på grund av sin joniseringskapacitet är bra ledare av elektricitet. I alkaliska batterier används till exempel kaliumhydroxid KOH som en elektrisk ledare..
Frätande effekt av baser
Starka baser kan skada organiska vävnader. Till exempel är köksugnsrengöringsmedel i allmänhet starka baser, och det rekommenderas alltid att hantera dem med yttersta försiktighet, med handskar och ögonskydd..
Svaga baser utgör en konjugerad motsvarighet
De svaga baserna när de är upplösta bildar en konjugerad motsvarighet, det vill säga en svag bas bildar en konjugerad syra.
Exempelvis tris- (hydroximetyl) amino-metan (OHCHtvå)3CNHtvå är en svag bas vars konjugerade syra är (OHCHtvå)3CNH3+:
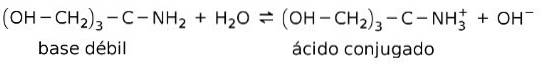
Detta är grunden för verkan av buffertämnen eller buffert, vilka är ämnen som används för att konstant hålla pH i lösningar.
Du kanske är intresserad av att känna till skillnaderna mellan syror och baser.



Ingen har kommenterat den här artikeln än.