
Cyklobutanstruktur, egenskaper, användningar och syntes

De cyklobutan är ett kolväte som består av en cykloalkan med fyra kol, vars molekylformel är C4H8. Det kan också kallas tetrametylen, med tanke på att de är fyra CH-enhetertvå som utgör en ring med fyrkantig geometri, även om namnet cyklobutan är mer accepterat och känt.
Vid rumstemperatur är det en färglös, brandfarlig gas som brinner med en ljus låga. Dess mest primitiva användning är som en värmekälla när man bränner den; Men dess strukturella bas (kvadrat) omfattar djupa biologiska och kemiska aspekter och samarbetar på ett visst sätt med egenskaperna hos dessa föreningar..
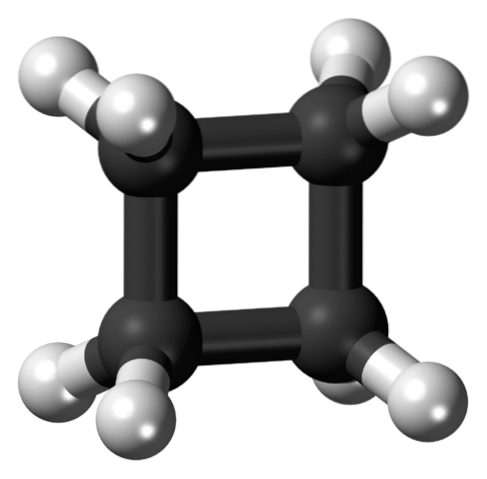
Den övre bilden visar en cyklobutanmolekyl med en fyrkantig struktur. I nästa avsnitt kommer vi att förklara varför denna konformation är instabil, eftersom dess länkar är spända..
Efter cyklopropan är det den mest instabila cykloalkanen, eftersom ju mindre ringstorleken är desto mer reaktiv blir den. Enligt detta är cyklobutanen mer instabil än pentan- och hexancyklerna. Det är dock nyfiken att i dess derivat bevittna en kärna eller ett fyrkantigt hjärta, som, som kommer att ses, är dynamiskt.
Artikelindex
- 1 Struktur av cyklobutan
- 1.1 Fjäril eller skrynkliga konformationer
- 1.2 Intermolekylära interaktioner
- 2 fastigheter
- 2.1 Fysiskt utseende
- 2.2 Molekylär massa
- 2.3 Kokpunkt
- 2.4 Smältpunkt
- 2.5 Flampunkt
- 2.6 Löslighet
- 2.7 Densitet
- 2.8 Ångdensitet
- 2.9 Ångtryck
- 2.10 Brytningsindex
- 2.11 Förbränningens entalpi
- 2.12 Bildningsvärme
- 3 Syntes
- 4 användningsområden
- 5 Referenser
Struktur av cyklobutan
I den första bilden närmade sig cyklobutanstrukturen som en enkel karboniserad och hydrerad kvadrat. I detta perfekta kvadrat lider emellertid orbitalerna av en kraftig vridning från sina ursprungliga vinklar: de är åtskilda med en vinkel på 90 ° jämfört med 109,5 ° för en kolatom med SP-hybridisering.3 (vinkelspänning).
Kolatomer sp3 de är tetraeder, och för vissa tetraeder skulle det vara svårt att böja deras orbitaler så mycket för att skapa en 90 ° vinkel; men det skulle vara ännu mer så för kol med SP-hybridiseringtvå (120º) och sp (180º) avviker sina ursprungliga vinklar. Av denna anledning har cyklobutan sp kolatomer3 i huvudsak.
Väteatomer är också mycket nära varandra, förmörkade i rymden. Detta resulterar i en ökning av steriskt hinder, vilket försvagar den förmodade kvadraten på grund av dess höga torsionsspänning..
Därför gör vinkel- och torsionsspänningar (inkapslade i termen "ringspänning") denna konformation instabil under normala förhållanden..
Cyklobutanmolekylen kommer att försöka minska båda spänningarna, och för att uppnå detta antar den vad som kallas fjäril eller puckered konformation..
Fjäril eller skrynkliga konformationer
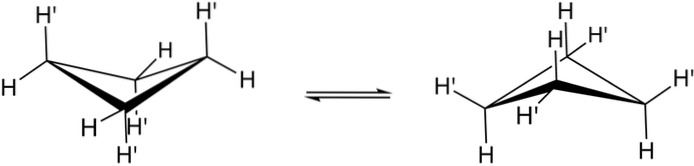
De verkliga konformationerna av cyklobutan visas ovan. I dem minskar vinkel- och torsionsspänningarna; eftersom, som kan ses, nu inte alla väteatomer är förmörkade. Det finns dock en energikostnad: vinkeln på dess länkar skärps, det vill säga den faller från 90 till 88 °.
Observera att det kan jämföras med en fjäril, vars triangulära vingar består av tre kolatomer; och den fjärde, placerad i en vinkel på 25 ° i förhållande till varje vinge. Tvåvägspilarna indikerar att det finns en jämvikt mellan båda konformerna. Det är som om fjärilen gick ner och lyfte sina vingar.
I cyklobutanderivat, å andra sidan, skulle denna klaff förväntas bli mycket långsammare och rumsligt hindrad..
Intermolekylära interaktioner
Antag att du glömmer fyrkanten ett ögonblick, och de ersätts av kolsyrade fjärilar istället. Dessa kan i sina klaffar bara hållas samman i vätskan av Londons dispersionskrafter, som är proportionella mot vingarna och deras molekylvikt..
Egenskaper
Fysiskt utseende
Färglös gas.
Molekylär massa
56,107 g / mol.
Kokpunkt
12,6 ° C Därför kunde det i kalla förhållanden hanteras i princip som vilken vätska som helst; med den enda detalj, att det skulle vara mycket flyktigt, och dess ångor fortfarande skulle utgöra en risk som ska beaktas.
Smältpunkt
-91ºC.
antändningspunkt
50ºC stängt glas.
Löslighet
Olösligt i vatten, vilket inte är förvånande med tanke på dess icke-polära natur; men det är något lösligt i alkoholer, eter och aceton, som är mindre polära lösningsmedel. Det förväntas vara lösligt (även om det inte rapporteras) logiskt i apolära lösningsmedel såsom koltetraklorid, bensen, xylen etc..
Densitet
0.7125 vid 5 ° C (i förhållande till 1 av vattnet).
Ång-densitet
1,93 (i förhållande till 1 av luften). Detta innebär att den är tätare än luft och därför, såvida det inte finns strömmar, kommer dess tendens inte att stiga..
Ångtryck
1180 mmHg vid 25 ° C.
Brytningsindex
1,3625 vid 290ºC.
Förbränningens entalpi
-655,9 kJ / mol.
Bildningsvärme
6,6 Kcal / mol vid 25 ° C.
Syntes
Cyklobutan syntetiseras genom hydrering av cyklobutadien, vars struktur är nästan densamma, med den enda skillnaden att den har en dubbelbindning; och därför är det ännu mer reaktivt. Detta är kanske den enklaste syntetiska vägen för att få den, eller åtminstone bara till den och inte till ett derivat.
I råolja är det osannolikt att få det eftersom det skulle sluta reagera på ett sådant sätt att det bryter ringen och bildar linjekedjan, det vill säga n-butan.
En annan metod för att erhålla cyklobutan består i att slå ultraviolett strålning på etenmolekylerna, CHtvå= CHtvå, som dimeriserar. Denna reaktion gynnas fotokemiskt, men inte termodynamiskt:
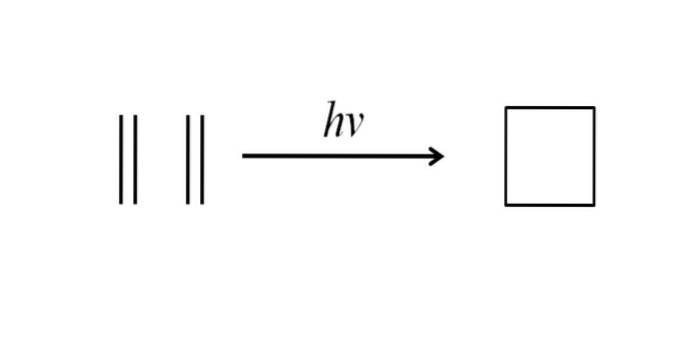
Bilden ovan sammanfattar mycket väl vad som sägs i avsnittet ovan. Om man istället för eten hade exempelvis två alkener, skulle en substituerad cyklobutan erhållas; eller vad är detsamma, ett derivat av cyklobutan. I själva verket har många derivat med intressanta strukturer syntetiserats med denna metod..
Andra derivat involverar emellertid en serie komplicerade syntetiska steg. Därför är cyklobutaner (som deras derivat kallas) föremål för studier för organiska synteser..
Applikationer
Enbart cyklobutan har ingen annan användning än att tjäna som värmekälla; men dess derivat går in i invecklad terräng i organisk syntes, med tillämpningar inom farmakologi, bioteknik och medicin. Utan att fördjupa sig i alltför komplexa strukturer är penitrems och grandisol exempel på cyklobutaner.
Cyklobutaner har i allmänhet egenskaper som är fördelaktiga för metabolismen av bakterier, växter, marina ryggradslösa djur och svampar. De är biologiskt aktiva, och det är därför deras användning är mycket varierande och svår att specificera, eftersom var och en har sin speciella effekt på vissa organismer..
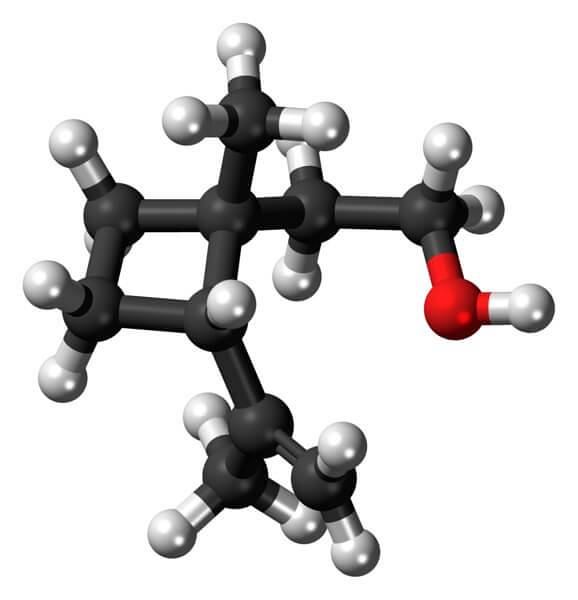
Grandisol är till exempel en feromon från viveln (en typ av skalbagge). Ovan och slutligen visas dess struktur, betraktad som en monoterpen med en kvadratisk bas av cyklobutan.
Referenser
- Carey F. (2008). Organisk kemi. (Sjätte upplagan). Mc Graw Hill.
- Graham Solomons, T.W. Craig B. Fryhle. (2011). Organisk kemi. (elvath utgåva). Wiley.
- Wikipedia. (2019). Cyklobutan. Återställd från: en.wikipedia.org
- PubChem. (2019). Cyklobutan. Återställd från: pubchem.ncbi.nlm.nih.gov
- Peiris Nicole. (2015, 29 november). Fysikaliska egenskaper hos cykloalkaner. Kemi LibreTexts. Återställd från: chem.libretexts.org
- Wiberg B. Kenneth. (2005). Cyklobutan-fysiska egenskaper och teoretiska studier. Institutionen för kemi, Yale University.
- Klement Foo. (s.f.). Cyklobutaner i organisk syntes. Återställd från: scripps.edu
- Myers. (s.f.). Cyklobutansyntes. Chem 115. Återställd från: hwpi.harvard.edu



Ingen har kommenterat den här artikeln än.