
Bromsyra (HBrO3) egenskaper, risker och användningar
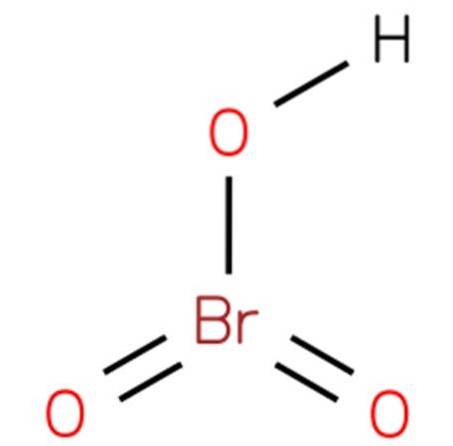
De bromsyra, Även känd som vätebromat eller bromsyra (V), är det en kemisk förening med formeln HBrO3. Det är en bromsyra med en struktur som är analog med klorsyra (EMBL-EBI, 2014). Föreningen är en mycket stark syra. Dess struktur presenteras i figur 1 (EMBL-EBI, 2008).
För att framställa bromsyra löses vanligen ett lösligt bromat i vatten och ett lösligt bariumsalt tillsätts. Låglösligt bariumbromat fälls ut.
Bariumbromaten kan sedan lösas i vatten och surgöras med svavelsyra för att fälla ut det i princip olösliga bariumsulfatet och lämna bromsyran bakom (se bilden ovan):
2KBrO3 (aq) + BaCl2 (aq) -> Ba (BrO3) 2 (s) + 2KCl (aq)
Ba (BrO3) 2 (aq) + H2SO4 (aq) -> 2HBrO3 + BaSO4
Föreningen kan också framställas genom sönderdelning av brompentaklorid i alkalisk lösning enligt reaktionen:
BrCl5 + 3 H2O → HBrO3 + 5 HCl
Bromsyra är ett starkt oxidationsmedel. Bromatjonen kan oxideras ytterligare med elementärt fluor eller xenondifluorid i närvaro av bas, oxidation åtföljd av små explosioner och Teflon-röret fångas i eld (My Favorite Chemicals, S.F.).
Artikelindex
- 1 Fysikaliska och kemiska egenskaper hos bromsyra
- 2 Reaktivitet och faror
- 2.1 Vid kontakt med ögonen
- 2.2 Vid hudkontakt
- 2.3 Vid inandning
- 3 användningsområden
- 4 Referenser
Fysikaliska och kemiska egenskaper hos bromsyra
Bromsyra finns endast i färglös lösning (upp till 50% vikt / volym) som blir gulaktig i kontakt med luft (National Center for Biotechnology Information., 2017). Dess utseende visas i figur 2.

Föreningen har en molekylvikt av 128,91 g / mol och sönderdelas vid 100 ° C och har en pKa av -2. Eftersom det var en instabil förening, erhölls dess fysikalisk-kemiska egenskaper genom beräkningsberäkningar..
Den har en smältpunkt på 206,04 ° C, en kokpunkt på 517,26 ° C och en löslighet i vatten på 1 x 106 mg / l vid 25 ° C (Royal Society of Chemistry, 2015).
Föreningen är ett starkt oxidationsmedel. När den blandas med etanol eller eter sönderdelas den för att bilda ättiksyra i en exoterm reaktion. Det är viktigt för framställning av bromatsalter (BrO3-) som framställs genom att reagera karbonater eller metalloxider med bromsyra (Watts, 1870).
Reaktivitet och faror
Bromsyra är en instabil förening som bryts ned till elementärt brom. Eftersom det är en stark syra är det extremt farligt vid hudkontakt (frätande och irriterande), i kontakt med ögonen (irriterande) och vid förtäring. Mycket farligt också vid inandning.
Allvarlig överexponering kan orsaka lungskador, kvävning, medvetslöshet eller dödsfall. Långvarig exponering kan orsaka brännskador och sår på huden. Överexponering vid inandning kan orsaka irritation i andningsorganen..
Inflammation i ögat kännetecknas av rodnad, vattning och klåda. Inflammation i huden kännetecknas av klåda, skalning, rodnad och ibland blåsor.
Ämnet är giftigt för njurar, lungor och slemhinnor. Upprepad eller långvarig exponering för ämnet kan skada dessa organ..
Vid kontakt med ögonen
Kontrollera om kontaktlinser används och ta bort dem omedelbart. Ögonen ska spolas med rinnande vatten i minst 15 minuter, så att ögonlocken hålls öppna. Kallt vatten kan användas. Ögonsalva ska inte användas.
Vid hudkontakt
Om kemikalien kommer i kontakt med kläder ska du ta bort den så snabbt som möjligt och skydda dina egna händer och kropp. Placera offret under en säkerhetsdusch.
Om kemikalien ansamlas på utsatt hud, t.ex. händer, tvättas den förorenade huden försiktigt och försiktigt med rinnande vatten och icke-slipande tvål. Kallt vatten kan användas. Om irritation kvarstår, kontakta läkare. Tvätta de förorenade kläderna innan du använder dem igen.
Om hudkontakten är svår bör den tvättas med ett desinfektionsmedel och tvätta den förorenade huden med en antibakteriell kräm..
Vid inandning
Det är tillrådligt att låta offret vila i ett väl ventilerat område. Om inandning är svår bör offret evakueras till ett säkert område så snart som möjligt. Lossa trånga kläder som en skjortkrage, bälte eller slips. Om offret har svårt att andas bör syre ges.
Om offret inte andas utförs återupplivning från mun till mun. Tänk alltid på att det kan vara farligt för personen som ger hjälp att ge återupplivning från mun till mun när det inandade materialet är giftigt, smittsamt eller frätande..
Framkalla inte kräkning vid förtäring. Lossa trånga kläder som skjortkrage, bälten eller slipsar. Om offret inte andas, utför återupplivning från mun till mun.
Sök alltid läkare omedelbart..
Applikationer
Bromsyra används som ett kraftfullt oxidationsmedel vid laboratoriereaktioner. Det används för att producera kemiska föreningar som jodater, klorsyra, tetraihonsyra bland andra..
Det används också för produktion av bromater som bland annat järn, bly, mangan och kvicksilverbromat..
Bromsyra fungerar som en viktig mellanprodukt i Bélousov-Zhabotinsky-reaktionen (Morris, 2010). Denna reaktion är ett exempel på kemiska klockor och illustrerar en termodynamisk icke-jämviktsreaktion.
Svängningsreaktionen katalyseras av cerium och är i sig kopplad till kemin hos bromoxosyror HBrOx. Det växande intresset för icke-linjära kemiska system har gett starka incitament för att studera kemin i brom..
I Belousov-Zhabotinsky-reaktionen är de involverade bromföreningarna hypobromsyra HOBr, bromsyra HOBrO och bromsyra HBrO3 (3) (Rainer Glaser, 2013).
Dessa typer av reaktioner är viktiga för teoretisk kemi. De visar att kemiska reaktioner inte behöver domineras av jämviktstermodynamiskt beteende.
Referenser
- Bromsyra. (S.F.). Återställd från chemyq.com.
- EMBL-EBI. (2008, 16 maj). bromsyra. Återställd från ebi.ac.uk.
- EMBL-EBI. (2014, 28 juli). klorsyra. Återställd från ebi.ac.uk.
- Morris, S. (2010, 23 januari). Belousov Zhabotinsky-reaktion 8 x normal hastighet. Återställd från youtubecom.
- Mina favoritkemikalier. (S.F.). Återställd från bromicacid.com.
- Nationellt centrum för bioteknikinformation. (2017, 11 mars). PubChem Compound Database; CID = 24445 ,. Hämtad från PubChem.
- Rainer Glaser, M. D. (2013). Varför surhetsgrad av bromsyra verkligen är viktigt för kinetiska modeller av Belousov-Zhabotinsky oscillerande kemiska reaktioner. Journal of Thermodynamics & Catalysis 4: 1.
- Royal Society of Chemistry. (2015). Bromsyra. Återställd från chemspider.com.
- Watts, H. (1870). A Dictionary of Chemistry and Allied Branches of Other Sciences, Volym 1. London: longmans, green and co.



Ingen har kommenterat den här artikeln än.