
Citronsyras struktur, egenskaper, produktion och användningsområden
De citronsyra är en organisk förening som består av en svag syra vars kemiska formel är C6H8ELLER7. Som namnet antyder är en av dess viktigaste naturliga källor citrusfrukter, och det härrör också från det latinska ordet "citrus", vilket betyder bitter..
Det är inte bara en svag syra, den är också polyprotisk; det vill säga det kan frigöra mer än en vätejon, H+. Det är just en trikarboxylsyra, så den har tre -COOH-grupper som donerar H-joner+. Var och en av dem har sin egen tendens att befria sig i sin miljö..

Därför är dess strukturformel bättre definierad som C3H5O (COOH)3. Detta är den kemiska orsaken till dess bidrag till den karakteristiska smaken av till exempel apelsinsegment. Även om den kommer från frukten, isolerades dess kristaller inte förrän 1784 från en citronsaft i England.
Det utgör cirka 8 viktprocent av vissa citrusfrukter, såsom citroner och grapefrukt. Det finns också i paprika, tomater, kronärtskockor och andra livsmedel..
Artikelindex
- 1 Var finns citronsyra?
- 2 Struktur av citronsyra
- 2.1 Intermolekylära interaktioner
- 3 Fysikaliska och kemiska egenskaper
- 3.1 Molekylvikt
- 3.2 Fysiskt utseende
- 3.3 Smak
- 3.4 Smältpunkt
- 3.5 Kokpunkt
- 3.6 Densitet
- 3.7 Löslighet
- 3,8 pKa
- 3.9 Sönderfall
- 3.10 Derivat
- 4 Produktion
- 4.1 Kemisk eller syntetisk syntes
- 4.2 Naturligt
- 4.3 Genom jäsning
- 5 användningsområden
- 5.1 I livsmedelsindustrin
- 5.2 Inom läkemedelsindustrin
- 5.3 I kosmetikindustrin och i allmänhet
- 6 Toxicitet
- 7 Referenser
Var finns citronsyra?
Det finns i låga proportioner i alla växter och djur, och det är en metabolit av levande varelser. Det är en mellanförening med aerob metabolism närvarande i trikarboxylsyracykeln eller citronsyracykeln. I biologi eller biokemi är denna cykel också känd som Krebs-cykeln, en amfibolväg för metabolism.
Förutom att det finns naturligt i växter och djur, erhålls denna syra syntetiskt i stor skala genom jäsning..
Det används ofta i livsmedelsindustrin, i läkemedel och kemikalier, och det fungerar som ett naturligt konserveringsmedel. Det och dess derivat tillverkas massivt på industriell nivå för att smaka fasta och flytande livsmedel.
Hittar användning som tillsats i olika hudskönhetsprodukter; den används också som ett kelaterande, försurande och antioxidant medel. Användningen i höga eller rena koncentrationer rekommenderas dock inte; eftersom det kan orsaka irritation, allergier och till och med cancer.
Citronsyrastruktur
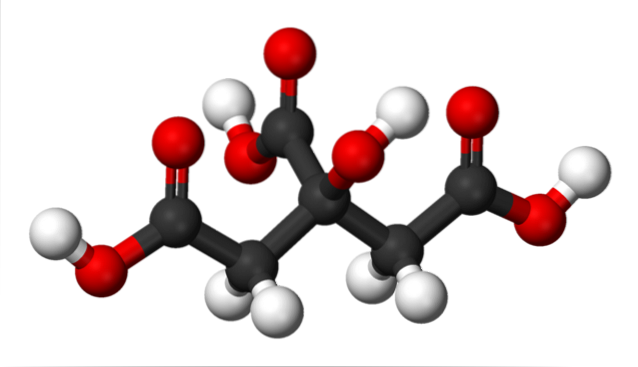
I den övre bilden representeras citronsyrans struktur med en sfär- och stapelmodell. Om du tittar noga kan du hitta skelettet på bara tre kol: propan.
Kolatomen i centrum är kopplad till en grupp -OH, som i närvaro av karboxylgrupper, -COOH, antar terminologin 'hydroxi'. De tre -COOH-grupperna är lätt igenkännliga i vänstra och högra änden och högst upp i strukturen; Det är från dessa där H släpps+.
Å andra sidan kan -OH-gruppen också kunna förlora en sur proton, så totalt sett skulle det inte finnas tre H+, men fyra. Den senare kräver emellertid en avsevärt stark bas, och följaktligen är dess bidrag till den karakteristiska surheten hos citronsyra mycket mindre jämfört med den för -COOH-grupperna..
Av allt ovanstående följer att citronsyra också kan kallas: 2-hydroxi-1,2,3-trikarboxylpropan.
Det finns en -OH-grupp i C-2, som ligger intill -COOH-gruppen (titta på strukturens övre centrum). På grund av detta faller citronsyra också under klassificeringen av alfa-hydroxisyror; där alfa betyder "intilliggande", det vill säga det finns bara en kolatom som separerar -COOH och -OH.
Intermolekylära interaktioner
Som framgår har citronsyrastrukturen en hög kapacitet att donera och acceptera vätebindningar. Detta gör det mycket relaterat till vatten, och också anledningen till att det bildar ett monohydrat fast, rombohedrala kristaller, mycket lätt..
Dessa vätebindningar är också ansvariga för att bygga upp de färglösa monokliniska kristallerna av citronsyra. Vattenfria kristaller (utan vatten) kan erhållas efter bildning i varmt vatten, följt av fullständig avdunstning..
Fysiska och kemiska egenskaper
Molekylvikt
210,14 g / mol.
Fysiskt utseende
Färglösa och luktfria syrakristaller.
Smak
Sur och bitter.
Smältpunkt
153 ° C.
Kokpunkt
175 ° C.
Densitet
1,66 g / ml.
Löslighet
Det är en mycket löslig förening i vatten. Det är också mycket lösligt i andra polära lösningsmedel såsom etanol och etylacetat. I apolära och aromatiska lösningsmedel som bensen, toluen, kloroform och xylen är det olösligt.
pKa
-3.1
-4.7
-6.4
Dessa är pKa-värdena för var och en av de tre -COOH-grupperna. Observera att den tredje pKa (6,4) knappt är något sur, så den dissocierar lite.
Sönderfall
Vid extrema temperaturer eller över 175 ° C sönderdelas den och frigör COtvå och vatten. Därför når vätskan inte någon betydande koka då den först sönderdelas..
Derivat
När du förlorar H+, andra katjoner tar sin plats men på ett joniskt sätt; det vill säga de negativa laddningarna för -COO-grupperna- locka andra arter av positiva laddningar, såsom Na+. Ju mer deprotonerad citronsyra är, desto fler katjoner har dess derivat som kallas citrater.
Ett exempel är natriumcitrat, som har en mycket användbar kelaterande effekt som koaguleringsmedel. Dessa citrater kan därför bilda komplex med metaller i lösning..
Å andra sidan har H+ av -COOH-grupperna kan till och med vara substituerade med andra kovalent bundna arter, såsom R-sidokedjor, vilket ger upphov till citratestrar: C3H5ELLER (COOR)3.
Mångfalden är mycket stor, eftersom inte alla H nödvändigtvis måste ersättas med R utan också med katjoner.
Produktion
Citronsyra kan framställas naturligt och kommersiellt genom fermentering av kolhydrater. Dess produktion har också genomförts syntetiskt genom kemiska processer som inte hålls mycket aktuella idag..
Flera biotekniska processer har använts för dess produktion, eftersom denna förening är i hög efterfrågan över hela världen.
Kemisk eller syntetisk syntes
-En av dessa kemiska syntesprocesser utförs under förhållanden med högt tryck från kalciumsalter av isocitrat. Saften extraherad från citrusfrukter behandlas med kalciumhydroxid och kalciumcitrat erhålls..
Detta salt extraheras sedan och reageras med en utspädd svavelsyralösning, vars funktion är att protonera citratet till dess ursprungliga syraform..
-Citronsyra har också syntetiserats från glycerin genom att ersätta dess komponenter med en karboxylgrupp. Som just nämnts är dessa processer inte optimala för storskalig produktion av citronsyra..
naturlig
I kroppen förekommer citronsyra naturligt i aerob metabolism: trikarboxylsyracykeln. När acetylkoenzym A (acetyl-CoA) går in i cykeln binder det med oxaloättiksyra och bildar citronsyra..
Och var kommer acetyl-CoA ifrån?
I reaktionerna av katabolismen av fettsyror, kolhydrater, bland andra substrat, i närvaro av Otvå acetyl-CoA produceras. Detta bildas som en produkt av beta-oxidation av fettsyror, av omvandlingen av pyruvat genererat vid glykolys.
Citronsyra bildad i Krebs-cykeln eller citronsyracykeln oxideras till alfa-ketoglutarsyra. Denna process representerar en amfibolisk oxidationsreduktionsväg, från vilken ekvivalenter genereras som sedan producerar energi eller ATP..
Den kommersiella produktionen av citronsyra som mellanprodukt för aerob metabolism har dock inte varit lönsam eller tillfredsställande heller. Endast under förhållanden med organisk obalans kan koncentrationen av denna metabolit ökas, vilket inte är livskraftigt för mikroorganismer.
Genom jäsning
Mikroorganismer, såsom svampar och bakterier, producerar citronsyra genom jäsning av sockerarter.
Produktionen av citronsyra från mikrobiell jäsning har gett bättre resultat än att erhålla den genom kemisk syntes. Forskningslinjer har utvecklats relaterade till denna mass kommersiella produktionsmetod, som har gett stora ekonomiska fördelar..
Odlingstekniker på industriell nivå har varierat över tiden. Kulturer för yt- och nedsänkt jäsning har använts. Nedsänkta kulturer är de där mikroorganismer producerar jäsning från substrat som finns i flytande media.
Produktionsprocesserna för citronsyra genom nedsänkt jäsning, som sker under anaeroba förhållanden, har varit optimala..
Några svampar gillar Aspergillus niger, Saccahromicopsis sp, och bakterier som Bacillus licheniformis, har tillåtit att få ett högt utbyte med denna typ av jäsning.
Svampar som Aspergillus niger eller candida sp, De producerar citronsyra som ett resultat av jäsning av melass och stärkelse. Bland annat rotting, majs och sockerbetor används också som fermenteringssubstrat..
Applikationer
Citronsyra används ofta i livsmedelsindustrin, vid tillverkning av farmaceutiska produkter. Det används också i otaliga kemiska och bioteknologiska processer..
I livsmedelsindustrin
-Citronsyra används främst i livsmedelsindustrin eftersom det ger dem en trevlig syrlig smak. Det är mycket lösligt i vatten, så det läggs till drycker, godis, godis, gelé och frysta frukter. Det används också vid beredning av vin, öl och andra drycker..
-Förutom att tillsätta en syrlig smak inaktiverar den spårämnen som skyddar askorbinsyra eller vitamin C. Det fungerar också som emulgeringsmedel i glass och ostar. Bidrar till inaktivering av oxidativa enzymer genom att sänka matens pH.
-Ökar effektiviteten av konserveringsmedel som läggs till maten. Genom att tillhandahålla ett relativt lågt pH minskar sannolikheten för att mikroorganismer överlever i bearbetade livsmedel, vilket ökar deras hållbarhet..
-I fetter och oljor används citronsyra för att förstärka den synergistiska antioxidanteffekten (av alla fettkomponenter) som denna typ av näringsämnen kan ha..
Inom läkemedelsindustrin
-Citronsyra används också i stor utsträckning som hjälpämne i läkemedelsindustrin för att förbättra smaken och upplösningen av läkemedel..
-I kombination med bikarbonat tillsätts citronsyra till pulver- och tablettprodukter på ett sätt som fungerar som ett brusande.
-Salterna av citronsyra tillåter dess användning som ett antikoagulant, eftersom det har förmågan att kelera kalcium. Citronsyra administreras i mineraltillskott såsom citratsalter.
-Genom att sura mediet i absorptionsprocessen på tarmnivån optimerar citronsyra upptagningen av vitaminer och vissa läkemedel. Dess vattenfria form administreras som ett komplement till andra läkemedel vid upplösning av stenar.
-Det används också som ett surgörande medel, sammandragande, som ett medel som underlättar upplösningen av de aktiva ingredienserna i olika farmaceutiska produkter..
I den kosmetiska industrin och i allmänhet
-Citronsyra används som kelateringsmedel för metalljoner i toalettartiklar och kosmetika..
-Det används för rengöring och polering av metaller i allmänhet, för att ta bort den oxid som täcker dem.
-I låga koncentrationer fungerar det som tillsats i ekologiska rengöringsprodukter som är godartade för miljö och natur..
-Den har en mängd olika användningsområden: den används i fotografiska reagenser, textilier, vid lädergarvning.
-Lägger till tryckfärger.
Giftighet
Rapporter om dess toxicitet är associerade med en hög koncentration av citronsyra, exponeringstid, föroreningar, bland andra faktorer..
Citronsyralösningar som är utspädda utgör ingen hälsorisk. Men ren eller koncentrerad citronsyra utgör en säkerhetsrisk och bör därför inte konsumeras..
Ren eller koncentrerad, är frätande och irriterande vid kontakt med hud och slemhinnor i ögon, näsa och hals. Kan orsaka allergiska hudreaktioner och akut toxicitet vid förtäring..
Inandning av rent citronsyradamm kan också påverka luftvägarnas slemhinna. Inandning kan orsaka andfåddhet, allergier, sensibilisering av andningsslemhinnan och kan till och med utlösa astma.
Reproduktionstoxiska effekter rapporteras. Citronsyra kan orsaka genetiska defekter och orsaka mutation i könsceller.
Och slutligen anses det vara farligt eller giftigt för vattenlevande livsmiljöer, och i allmänhet är koncentrerad citronsyra frätande för metaller..
Referenser
- BellChem (21 april 2015). Användningen av citronsyra i livsmedelsindustrin. Återställd från: bellchem.com
- Vandenberghe, Luciana P. S, Soccol, Carlos R, Pandey, Ashok, & Lebeault, Jean-Michel. (1999). Mikrobiell produktion av citronsyra. Brazilian Archives of Biology and Technology, 42 (3), 263-276. dx.doi.org/10.1590/S1516-89131999000300001
- PubChem. (2018). Citronsyra. Återställd från: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Citronsyra. Återställd från: en.wikipedia.org
- Whitten, K., Davis, R., Peck M. och Stanley, G. (2008). Kemi. (8ava. ed). CENGAGE Inlärning: Mexiko.
- Berovic, M. och Legisa, M. (2007). Produktion av citronsyra. Årsöversikt över bioteknik. Återställd från: researchgate.net



Ingen har kommenterat den här artikeln än.