
Fosforsyra (H3PO4) struktur, egenskaper, användningsområden

De fosforsyra Det är en oxosyra av fosfor som har den kemiska formeln H3PO4. Den består av en mineralsyra i vilken tre sura protoner är bundna till fosfatanjonen (PO43-). Även om den inte anses vara en stark syra, kan dess felaktiga användning utgöra en hälsorisk.
Det finns i två tillstånd: som ett fast ämne i form av tjocka ortorombiska kristaller eller som en kristallin vätska med ett sirapigt utseende. Dess vanligaste kommersiella presentation har en koncentration på 85% vikt / vikt och en densitet på 1,685 g / cm3. Denna densitet kommer från koncentrationen.
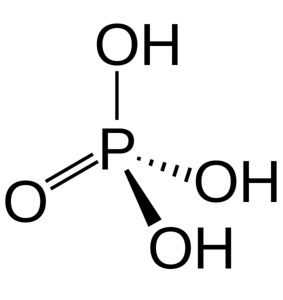
De tre OH-grupperna är ansvariga för donering av sura väten. På grund av närvaron av dem i dess struktur kan den reagera med olika hydroxider med ursprung i olika salter.
När det gäller natriumhydroxid kan den bilda tre: monobasiskt natriumfosfat (NaHtvåPO4dibasiskt natriumfosfat (NatvåHPO4) och tribasiskt natriumfosfat (Na3PO4).
Beroende på vilken bas som används för neutralisering eller vilka katjoner som är mycket nära den kan den dock bilda andra fosfatsalter. Bland dem är: kalciumfosfat (Ca3(PO4)två), litiumfosfat (Li3PO4järnfosfat (FePO4), och andra. Var och en med sina olika grader av protonering av fosfatanjonen.
Å andra sidan kan fosforsyra "sekvestrera" tvåvärda katjoner såsom Fetvå+, Cutvå+, ACtvå+ och Mgtvå+. Vid förhöjda temperaturer kan den reagera med sig själv med förlusten av en H-molekyltvåEller bilda dimerer, trimerer och polymerer av fosforsyror.
Denna typ av reaktion gör denna förening kapabel att skapa ett stort antal strukturer med fosfor- och syreskelett, från vilka ett brett spektrum av salter som kallas polyfosfater också kan erhållas..
När det gäller upptäckten syntetiserades den 1694 av Robert Boyle och upplöste PtvåELLER5 (fosforpentoxid) i vatten. Det är en av de mest användbara mineralsyrorna, dess funktion som gödningsmedel är den viktigaste. Fosfor, tillsammans med kalium och kväve, utgör de tre viktigaste växtnäringsämnena.
Artikelindex
- 1 Kemisk struktur
- 1.1 Difosforsyra (H4P2O7)
- 1.2 Polyfosforsyror
- 1.3 Cykliska polyfosforsyror
- 2 Nomenklatur
- 2.1 Ortho
- 2.2 Pyro
- 2.3 Mål
- 3 fastigheter
- 3.1 Molekylformel
- 3.2 Molekylvikt
- 3.3 Fysiskt utseende
- 3.4 Kok- och smältpunkter
- 3.5 Löslighet i vatten
- 3.6 Densitet
- 3.7 Ångdensitet
- 3.8 Självantändning
- 3.9 Viskositet
- 3.10 Surhet
- 3.11 Sönderfall
- 3.12 Korrosivitet
- 3.13 Polymerisering
- 4 användningsområden
- 4.1 Fosfatsalter och allmän användning
- 4.2 Industriell
- 4.3 Dental
- 4.4 Kosmetika
- 5 Bildning av fosforsyra
- 6 risker
- 7 Referenser
Kemisk struktur
Fosforsyra består av en P = O-bindning och tre P-OH, där den senare är bärarna av de sura vätena som frigörs i ett upplösningsmedium. Med fosforatomen i centrum drar oxygener en slags molekylär tetraeder.
På detta sätt kan fosforsyra visualiseras som en tetraeder. Ur detta perspektiv sa tetraedra (av enheter av H3PO4) interagerar med varandra genom vätebindningar; det vill säga dess hörn är ungefärliga.
Dessa intermolekylära interaktioner tillåter fosforsyra att kristallisera till två fasta ämnen: det vattenfria och hemihydratet (H3PO41 / 2HtvåO), båda med monokliniska kristallsystem. Dess vattenfria form kan också beskrivas med formeln: 3HtvåO · PtvåELLER5, som är lika med en trihydrerad fosforpentoxid.
Tetrahedra kan till och med bli kovalent kopplade, men för detta måste en av deras enheter eliminera en vattenmolekyl genom uttorkning. Detta inträffar när H3PO4 värms upp och genererar följaktligen bildandet av polyfosforsyror (PA).
Difosforsyra (H4PtvåELLER7)
Den enklaste av alla PA är difosforsyra (H.4PtvåELLER7), även känd som pyrofosforsyra. Den kemiska ekvationen för dess bildning är som följer:
2H3PO4 <=> H4PtvåELLER7 + HtvåELLER
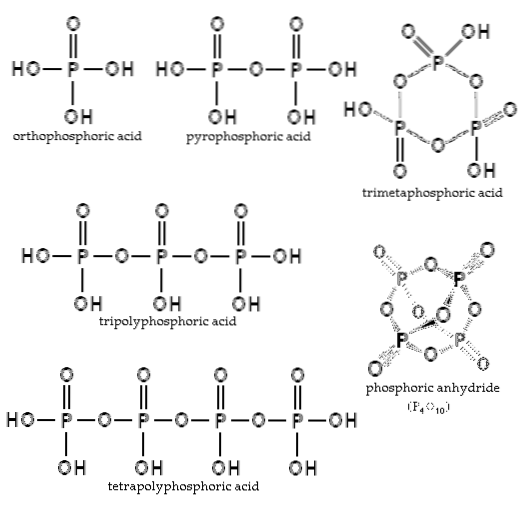
Balansen beror på mängden vatten och temperaturen. Vad är dess struktur? I bilden av avsnittet visas strukturerna av ortofosforsyra och pyrofosforsyra i det övre vänstra hörnet..
Två enheter förenas kovalent när en vattenmolekyl elimineras och bildar en P-O-P syrebro mellan dem. Nu är de inte tre sura väten, utan fyra (fyra-OH-grupper). På grund av detta har H4PtvåELLER7 har fyra joniseringskonstanter ktill.
Polyfosforsyror
Dehydrering kan fortsätta med pyrofosforsyra om uppvärmningen fortsätter. Varför? Eftersom det i varje ände av sin molekyl finns en OH-grupp som kan avlägsnas som en vattenmolekyl, vilket främjar den efterföljande tillväxten av P-O-P-O-P-skelettet ...
Exempel på dessa syror är tripolyfosforsyra och tetrapolyfosforsyra (båda illustrerade i bilden). Man kan se hur P-O-P-ryggraden förlängs i en slags kedja som består av tetraeder.
Dessa föreningar kan representeras av formeln HO (POtvåÅH)xH, där HO är den extrema vänstern som kan uttorkas. POtvåOH är fosforstommen med P = O- och OH-bindningarna; och x är enheterna eller molekylerna av fosforsyror som är nödvändiga för att erhålla kedjan.
När dessa föreningar neutraliseras fullständigt med en bas skapas så kallade polyfosfater. Beroende på vilka katjoner som omger dem bildar de ett stort antal polyfosfatsalter.
Å andra sidan, om de reagerar med ROH-alkoholer, ersätts deras ryggradsväten med R-alkylsubstituenterna. Således uppstår fosfatestrarna (eller polyfosfaterna): RO (POtvåELLER)xR. Det räcker att ersätta H med R i alla strukturer för sektionens bild för att få dem.
Cykliska polyfosforsyror
P-O-P-kedjorna kan till och med stängas på en fosforring eller cykel. Den enklaste av denna typ av förening är trimetafosforsyra (bildens övre högra hörn). Således kan AP vara linjära, cykliska; eller om deras strukturer uppvisar båda typerna, grenade.
Nomenklatur
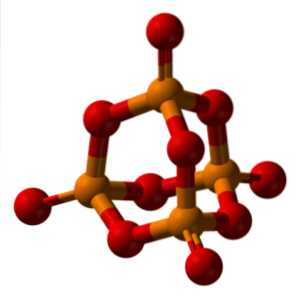
Nomenklaturen för fosforsyra dikteras av IUPAC och hur de ternära salterna av oxosyror heter.
För i H3PO4 P-atomen har valens +5, det högsta värdet, dess syra tilldelas suffixet -ico till prefixet fosfor-.
Orto
Emellertid kallas fosforsyra också ofta ortofosforsyra. Varför? Eftersom ordet "ortho" är grekiskt och betyder "sant"; vilket skulle översättas till den "sanna formen" eller "mer hydratiserad" av samma.
När vattenfri fosforsyra hydratiseras med ett överskott av vatten (P4ELLER10, fosfor "locket" i bilden ovan) produceras H3PO4 (3HtvåO · PtvåELLER5). Således tilldelas prefixet orto de syror som bildas med rikligt med vatten.
Pyro
Prefixet pyro hänvisar till vilken förening som helst som härrör från applicering av värme, eftersom difosforsyra uppstår genom termisk uttorkning av fosforsyra. Det kallas därför pyrofosforsyra (2HtvåO · PtvåELLER5).
Mål
Prefixet meta, som också är ett grekiskt ord, betyder "efter". Det läggs till de ämnen vars formel har eliminerat en molekyl, i detta fall, den av vatten:
H3PO4 => HPO3 + HtvåELLER
Observera att den här gången tillsättningen av två fosforenheter inte förekommer för att bilda difosforsyra, utan istället erhålls metafosforsyra (av vilken det inte finns några bevis för dess existens).
Det är också viktigt att notera att denna syra kan beskrivas som HtvåO · PtvåELLER5 (liknar hemidrat, multiplicerar HPO3 För 2). Metaprefixet kommer helt i linje med cykliskt PA, eftersom om trifosforsyran torkar ut men inte lägger till ytterligare en H-enhet3PO4 för att bli tetrafosforsyra måste den bilda en ring.
Och detta är detsamma med andra polymetafosforsyror, även om IUPAC rekommenderar att man kallar dem cykliska föreningar av motsvarande PA..
Egenskaper
Molekylär formel
H3PO4
Molekylvikt
97,994 g / mol
Fysiskt utseende
I sin fasta form presenterar den ortorombiska, hygroskopiska och transparenta kristaller. I flytande form är den kristallin med en viskös sirap..
Det är kommersiellt tillgängligt i vattenlösning med en koncentration av 85% vikt / vikt. I alla dessa presentationer saknar det lukt.
Kok- och smältpunkter
158 ° C (316 ° F vid 760 mmHg).
42,2 ° C (108 ° F).
Vattenlöslighet
548 g / 100 g HtvåEller vid 20 ° C; 369,4 g / 100 ml vid 0,5 ° C; 446 g / 100 m vid 14,95 ° C.
Densitet
1892 g / cm3 (fast); 1,841 g / cm3 (100% lösning); 1,685 g / cm3 (85% lösning); 1334 g / cm3 50% lösning) vid 25 ° C.
Ång-densitet
I förhållande till luft 3,4 (luft = 1).
Självantändning
Det är inte brandfarligt.
Viskositet
3,86 mPoise (40% lösning vid 20 ° C).
Aciditet
pH: 1,5 (0,1 N lösning i vatten)
pKa: pKal = 2.148; pKa2 = 7,198 och pKa3 = 12,319. Därför är ditt suraste väte det första.
Sönderfall
Vid upphettning frigör den fosforoxider. Om temperaturen stiger till 213 ° C eller mer blir det pyrofosforsyra (H4PtvåELLER7).
Korrosivitet
Frätande för järnmetaller och aluminium. Att reagera med dessa metaller ger upphov till bränslegasen väte.
Polymerisation
Polymeriserar våldsamt med azoföreningar, epoxider och polymeriserbara föreningar.
Applikationer
Fosfatsalter och allmänt bruk
-Fosforsyra tjänar som grund för framställning av fosfater, som används som gödselmedel eftersom fosfor är ett huvudnäringsämne i växter..
-Det har använts vid behandling av blyförgiftning och andra tillstånd där det krävs betydande mängder fosfat och produktion av mild acidos.
-Det används för att kontrollera pH i minkens urinvägar och kostnader för att undvika att njursten bildas.
-Fosforsyra ger upphov till Na-saltertvåHPO4 och NaHtvåPO4 som utgör ett pH-buffersystem med ett pKa på 6,8. Detta pH-regleringssystem är närvarande hos människan, vilket är viktigt vid regleringen av det intracellulära pH-värdet, liksom vid hanteringen av vätgaskoncentrationen i de distala och uppsamlande tubulerna i nefronerna..
-Det används för att avlägsna det mögliga skiktet av järnoxid som ackumuleras på denna metall. Fosforsyra bildar järnfosfat som lätt kan avlägsnas från metallytan. Det används också vid elektrisk polering av aluminium och är ett bindemedel för eldfasta produkter såsom aluminiumoxid och magnesia..
Industriell
-Fosforsyra används som katalytiskt medel vid tillverkning av nylon och bensin. Det används som ett dehydratiseringsmedel vid litografisk gravering, vid framställning av färgämnen för användning i textilindustrin, i latexkoagulationsprocessen i gummiindustrin och vid rening av väteperoxid.
-Syran används som tillsats i kolsyrade drycker, vilket bidrar till dess smak. Utspädd appliceras i sockerraffinering. Det fungerar också som ett buffersystem vid beredning av skinka, gelatin och antibiotika..
-Det är involverat i produktionen av tvättmedel, i syrakatalysen av acetylenproduktion.
-Det används som ett surgörande medel i balanserad mat för boskapsindustrin och husdjur. Läkemedelsindustrin använder den vid tillverkning av antiemetiska läkemedel. Det används också i en blandning för att tillverka asfalt för att bana marken och reparera sprickor..
-Fosforsyra fungerar som en katalysator vid hydrering av alkener för att producera alkohol, huvudsakligen etanol. Dessutom används det vid bestämning av organiskt kol i jord.
Dental
Den används av tandläkare för att rengöra och konditionera tandytan innan tandstag placeras. Det finner också användning vid tandblekning och avlägsnande av tandplack. Dessutom används den vid tillverkning av lim för tandproteser.
Kosmetika
Fosforsyra används för att justera pH i kosmetiska produkter och hudvårdsprodukter. Det används som ett kemiskt oxidationsmedel för produktion av aktivt kol..
Bildning av fosforsyra
-Fosforsyra framställs av fosfatsten av apatit-typen genom uppslutning med koncentrerad svavelsyra:
AC3(PO4)två + 3 HtvåSW4 + 6 timmartvåO => 2 H3PO4 + 3 (CaSO4.2HtvåELLER)
Den fosforsyra som erhålls vid denna reaktion har låg renhet, så den genomgår en reningsprocess som inkluderar utfällning, lösningsmedelsextraktion, kristallisation och jonbytestekniker..
-Fosforsyra kan framställas genom att lösa upp fosforpentoxid i kokande vatten.
-Det kan också erhållas genom att värma fosfor med en blandning av luft och vattenånga:
P4 (l) + 5 Otvå (g) => P4ELLER10 (s)
P4ELLER10 (s) + HtvåO (g) => 4H3PO4 (l)
Risker
-Eftersom dess ångtryck är lågt vid rumstemperatur är det osannolikt att ångorna inandas om inte syra sprutas. I så fall inkluderar dina inandningssymptom: hosta, ont i halsen, andfåddhet och ansträngd andning..
-Litteraturen citerar fallet med en sjöman som utsattes för fosforsyraångor under lång tid. Han led av allmän svaghet, torr hosta, bröstsmärtor och andningsproblem. Inom ett år efter exponering observerades reaktiv luftvägsdysfunktion.
-Hudkontakt med fosforsyra kan orsaka rodnad, smärta, blåsor och brännskador på huden..
-Syrans kontakt med ögonen kan, beroende på dess koncentration och kontaktens varaktighet, orsaka frätande vävnadsskador eller svåra brännskador med permanent ögonskada..
-Förtäring av syran orsakar brännande i munnen och halsen, en brännande känsla bortom bröstbenet, buksmärtor, kräkningar, chock och kollaps.
Referenser
- Royal Society of Chemistry. (2015). Fosforsyra. Hämtad från: chemspider.com
- Canadian Center for Occupational Safety and Health. (1999). Fosforsyra - hälsoeffekter. Hämtad från: ccsso.ca
- Acids.Info. (2018). Fosforsyra "Olika användningar av denna kemiska förening. Hämtad från: acidos.info
- James P. Smith, Walter E. Brown och James R. Lehr. (1955). Struktur av kristallin fosforsyra. J. Am. Chem. Soc. 77, 10, 2728-2730
- Wikipedia. (2018). Fosforsyror och fosfater. Hämtad från: en.wikipedia.org
- Vetenskap är kul. Lär dig mer om fosforsyra. [PDF]. Hämtad från: scifun.chem.wisc.edu



Ingen har kommenterat den här artikeln än.