
Perbromsyra (HBrO4) egenskaper, risker och användningar

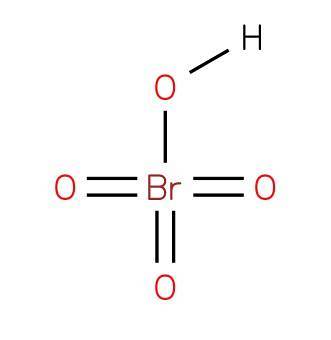
De perbromsyra eller tetraoxobromsyra är en oorganisk förening med formeln HBrO4. Dess struktur presenteras i figur 1 (EMBL-EBI, 2007). Det är en oxsyra bromsyra, där den har oxidationstillstånd 7+.
Den är instabil och kan inte bildas genom förflyttning av klor från perklorsyra när perbromsyra framställs; kan endast göras genom protonering av perbromatjonen.
Perbromsyra är en stark syra och ett kraftfullt oxidationsmedel. Det är den minst stabila av halogenoxiderna (VII). Sönderdelas snabbt till bromsyra och syre som frigör giftiga bruna bromångor.
Dess konjugatbas är perbromatjonen som, till skillnad från perklorater, inte är tillgänglig genom elektrolys. Det bildas genom att reagera bromat med ozon eller när perbromsyra reagerar med baser (Ropp, 2013). En ny syntes av perbromater har utvecklats, vilken består av oxidation av bromat med fluor i alkalisk lösning.
BrO3- + Ftvå + HtvåO → BrO4- + HF
Det upptäcktes genom förfallet av ett radioaktivt selenatprov (SeO4-). Föreningen framställs också genom att bromatkristaller utsätts för y-strålning (A. J. Downs, 1973)
Perbromsyra är en stark monobasinsyra. Dess vattenlösningar är stabila upp till cirka 6 M (55% HBrO4) men sönderdelas vid högre koncentrationer (Appelman, 1969).
Artikelindex
- 1 Fysikaliska och kemiska egenskaper
- 2 Reaktivitet och faror
- 3 användningsområden
- 4 Referenser
Fysiska och kemiska egenskaper
Perbromsyra finns endast i lösning. Det är en färglös vätska utan karaktäristisk arom (National Center for Biotechnology Information, 2017).
Föreningen har en molekylvikt av 144,908 g / mol. Med tanke på dess instabilitet beräknades dess egenskaper med beräkningsmetoder, varvid man fick en smält- och kokpunkt på 204,77 ° C respektive 512,23 ° C..
Dess löslighet i vatten, även erhållen genom beräkningsberäkningar, är i storleksordningen 1 x 106 mg per liter vid 25 ° C (Royal Society of Chemistry, 2015). Perbromsyra är en stark syra som bara har en proton för varje heptavalent bromatom. I vattenlösning dissocieras hydroniumjonen och BrO fullständigt4-.
Lösningar med koncentrationer större än 6M (55% vikt / volym) är instabila i luft, en autokatalytisk sönderdelning av föreningen sker, vilken är fullständig vid koncentrationer på 80%. Denna sönderdelningsreaktion katalyseras också av metaller såsom Ce4+ och Ag+ (Egon Wiberg, 2001).
Reaktivitet och faror
Perbromsyra är en instabil förening, men den har starka syraegenskaper när den isoleras. Det är extremt farligt vid kontakt med huden (det är frätande och irriterande), i kontakt med ögonen (irriterande) och vid förtäring. Också mycket farligt vid inandning.
Allvarlig överexponering kan orsaka lungskador, kvävning, medvetslöshet eller dödsfall. Långvarig exponering kan orsaka brännskador och sår på huden. Överexponering vid inandning kan orsaka irritation i andningsorganen..
Inflammation i ögat kännetecknas av rodnad, vattning och klåda. Inflammation i huden kännetecknas av klåda, skalning, rodnad och ibland blåsor.
Ämnet är giftigt för njurar, lungor och slemhinnor. Upprepad eller långvarig exponering för ämnet kan skada dessa organ..
Vid kontakt med ögonen, kontrollera om du har kontaktlinser och ta bort dem omedelbart. Ögonen ska spolas med rinnande vatten i minst 15 minuter, så att ögonlocken hålls öppna. Kallt vatten kan användas. Ögonsalva ska inte användas.
Om kemikalien kommer i kontakt med kläder ska du ta bort den så snabbt som möjligt och skydda dina egna händer och kropp. Placera offret under en säkerhetsdusch.
Om kemikalien ansamlas på utsatt hud, t.ex. händer, tvättas den förorenade huden försiktigt och försiktigt med rinnande vatten och icke-slipande tvål..
Syran kan också neutraliseras med utspädd natriumhydroxid eller en svag bas såsom bakpulver. Om irritation kvarstår, kontakta läkare. Tvätta de förorenade kläderna innan du använder dem igen.
Om hudkontakten är svår bör den tvättas med ett desinfektionsmedel och tvätta den förorenade huden med en antibakteriell kräm..
Vid inandning ska offret tillåtas vila i ett väl ventilerat område. Om inandning är svår bör offret evakueras till ett säkert område så snart som möjligt..
Lossa trånga kläder som en skjortkrage, bälte eller slips. Om offret har svårt att andas bör syre ges. Om offret inte andas utförs återupplivning från mun till mun.
Ta alltid hänsyn till att det kan vara farligt för den person som ger hjälp att ge återupplivning från mun till mun när det inandade materialet är giftigt, smittsamt eller frätande.
Framkalla inte kräkning vid förtäring. Lossa trånga kläder som skjortkrage, bälten eller slipsar. Om offret inte andas, utför återupplivning från mun till mun. Sök alltid läkare omedelbart..
Applikationer
Den huvudsakliga användningen av perbromsyra är som reduktionsmedel i laboratoriet. Utspädda perbromsyralösningar är långsamma oxidationsmedel trots deras stora potential REDOX (+1.76 volt) men det är en bättre oxidant än perklorsyra.
Perbromsyra kan långsamt oxidera bromid- och jodidjoner. I lösningar med 12 molär koncentration kan den snabbt oxidera kloridjonen och explodera i närvaro av salpetersyra. Lösningar med 3 molär koncentration av perbromsyra kan lätt oxidera rostfritt stål.
Vid en temperatur av 100 ° C kan 6 molära lösningar av perbromsyra oxidera manganjonen (Mntvå+till permanganat (MnO4-). Reduktion av föreningen till brom kan uppnås med tennklorid (SnOtvå).
Den andra användningen av perbrominsyra är syntesen av perbromattsalter, såsom natriumperbromat eller kaliumperbromat..
Den senare är en ganska stabil förening som motstår temperaturer på 274 ° C. Vid högre temperaturer reduceras det till kaliumbromat, till skillnad från perklorat som vid höga temperaturer producerar syre och kaliumklorid.
Referenser
- J. Downs, C. J. (1973). Kemi av klor, brom, jod och astatin. Oxford: Pergamon press LTD.
- Appelman, E. H. (1969). Perbromsyra och perbromer: Syntes och vissa egenskaper. Oorganisk kemi 8 (2) , 223-227. Återställd från researchgate.net.
- Egon Wiberg, N. W. (2001). Oorganisk kemi. New York: Academic Press.
- EMBL-EBI. (2007, 28 oktober). perbromsyra. Återställd från ebi.ac.uk.
- Nationellt centrum för bioteknikinformation. (2017, 30 april). PubChem Compound Database; CID = 192513. Återställd från pubchem.ncbi.nlm.nih.gov.
- Ropp, R. C. (2013). Encyclopedia of the Alkaline Earth Compounds. Oxford: Elsevier.
- Royal Society of Chemistry. (2015). Perbromsyra. Återställd från chemspider.com.



Ingen har kommenterat den här artikeln än.