
Vätesulfid (H2S) struktur, egenskaper, användningsområden, betydelse

De vätesulfid eller vätesulfid är en gas som bildas genom föreningen av en svavelatom (S) och två väteatomer (H). Dess kemiska formel är HtvåS. Även känd som vätesulfidgas. Det är en färglös gas vars lukt syns i ruttna ägg.
Den finns i vulkaner och svavelhaltiga varma källor, i naturgas och i råolja. Det bildas också under den anaeroba nedbrytningen (utan syre) av växt- och djurorganiskt material. Det förekommer naturligt i däggdjurskroppen genom inverkan av vissa enzymer på cystein, en icke-essentiell aminosyra.
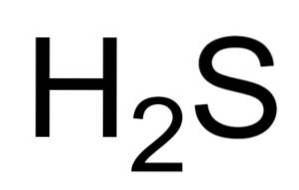
Vattenhaltiga lösningar av HtvåS är frätande för metaller som stål. HtvåS är en reducerande förening som, när den reagerar med SOtvå , oxiderar till elementärt svavel medan den reduceras till SOtvå även svavel.
Trots att det är en mycket giftig och dödlig förening för människor och djur har dess betydelse i en serie viktiga processer i kroppen studerats i några år..
Reglerar en serie mekanismer relaterade till genereringen av nya blodkärl och hjärtets funktion.
Skyddar nervceller och har ansetts agera mot sjukdomar som Parkinsons och Alzheimers.
På grund av sin kemiska reduceringsförmåga kan den bekämpa oxidativa arter och därmed motverka cellåldring. På grund av dessa skäl undersöks möjligheten att producera läkemedel som, när de ges till patienter långsamt i kroppen..
Detta skulle tjäna till att behandla patologier såsom ischemi, diabetes och neurodegenerativa sjukdomar. Men dess verkningsmekanism och säkerhet har ännu inte undersökts noggrant..
Artikelindex
- 1 Struktur
- 2 Nomenklatur
- 3 Fysiska egenskaper
- 3.1 Fysiskt tillstånd
- 3.2 Molekylvikt
- 3.3 Smältpunkt
- 3.4 Kokpunkt
- 3.5 Densitet
- 3.6 Löslighet
- 4 Kemiska egenskaper
- 4.1 I vattenlösning
- 4.2 Reaktion med syre
- 4.3 Reaktion med metaller
- 4.4 Reaktion med svaveldioxid
- 4.5 Sönderdelning med temperatur
- 5 Plats i naturen
- 6 Syntes i däggdjursorganismen
- 7 Erhålls i laboratoriet eller industriellt
- 8 Industriell användning av H2S för att producera svavel
- 9 Användbarhet eller betydelse av endogent H2S i kroppen
- 9.1 Hjärt-kärlsystemet
- 9.2 Magtarmsystemet
- 9.3 Centrala nervsystemet
- 9.4 Synsorgan
- 9.5 Mot åldrande
- 9.6 Läkningspotential för exogent tillförd H2S
- 10 risker
- 11 Referenser
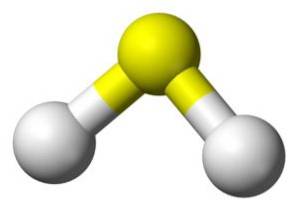
Strukturera
H-molekylentvåS är analog med det för vatten, det vill säga de har samma form eftersom vätena ligger i en vinkel med svavlet.
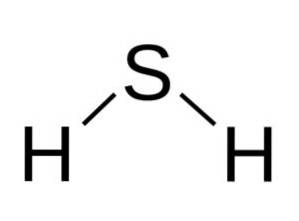
Svavel i HtvåS har följande elektroniska konfiguration:
1stvå, 2stvå 2 s6, 3stvå 3p6,
Tja, det lånar en elektron från varje väte för att slutföra sitt valensskal..
Nomenklatur
- Vätesulfid
- Vätesulfid
- Svavelhydrid.
Fysikaliska egenskaper
Fysiskt tillstånd
Färglös gas med mycket obehaglig lukt.
Molekylvikt
34,08 g / mol.
Smältpunkt
-85,60 ºC.
Kokpunkt
-60,75 ºC.
Densitet
1,1906 g / 1.
Löslighet
Måttligt lösligt i vatten: 2,77 volymer i 1 vatten vid 20 ° C. Kan lossas från vattenlösning helt genom kokning.
Kemiska egenskaper
I vattenlösning
När vätesulfid är i vattenlösning kallas det vätesulfid. Det är en svag syra. Den har två joniserbara protoner:
HtvåS + HtvåO ⇔ H3ELLER+ + HS-, Ka1 = 8,9 x 10-8
HS- + HtvåO ⇔ H3ELLER+ + Stvå-, Ka2 ∼ 10-14
Den första protonen joniseras något, vilket kan dras av dess första joniseringskonstant. Den andra protonen joniserar väldigt lite, men lösningar av HtvåS innehåller en del av sulfidanjonen Stvå-.
Om lösningen av HtvåS utsätts för luft, Otvå oxiderar till sulfidanjonen och fäller ut svavel:
2 Stvå- + 4 timmar+ + ELLERtvå → 2 HtvåO + 2 S0↓ (1)
I närvaro av klor Cltvå, brom Brtvå och jod Itvå motsvarande vätehalogenid och svavel bildas:
HtvåS + Brtvå → 2 HBr + S0↓ (2)
Vattenhaltiga lösningar av HtvåS är frätande, producerar sulfidspänningssprickning i stål med hög hårdhet. Korrosionsprodukter är järnsulfid och väte.
Reaktion med syre
HtvåS reagerar med syre i luften och följande reaktioner kan uppstå:
2 timmartvåS + 3 Otvå → 2 HtvåO + 2 SOtvå (3)
2 timmartvåS + Otvå → 2 HtvåO + 2 S0↓ (4)
Reaktion med metaller
Det reagerar med olika metaller som förskjuter väte och bildar metallsulfiden:
HtvåS + Pb → PbS + Htvå↑ (5)
Reaktion med svaveldioxid
I vulkaniska gaser, HtvåS och SOtvå, som reagerar med varandra och bildar fast svavel:
HtvåS + SOtvå → 2 HtvåO + 3 S0↓ (6)
Sönderdelning med temperatur
Vätesulfid är inte särskilt stabil, den sönderdelas lätt vid uppvärmning:
HtvåS → Htvå↑ + S0↓ (7)
Plats i naturen
Denna gas finns naturligt i svavel- eller svavelhaltiga varma källor, i vulkaniska gaser, i råolja och i naturgas..

När olja (eller gas) innehåller betydande spår av HtvåS sägs vara "surt", i motsats till "sött", det är när det inte innehåller det.
Små mängder HtvåS i olja eller gas är ekonomiskt skadligt eftersom en tvättanläggning måste installeras för att ta bort den, både för att förhindra korrosion och för att göra avgasen säker för hushållsbruk som bränsle.
Det produceras när organiskt material som innehåller svavel sönderdelas under anaeroba förhållanden (frånvaro av luft), såsom humant, animaliskt och växtavfall.

Bakterier som finns i munnen och i mag-tarmkanalen producerar det från de nedbrytbara materialen som finns i växter eller animaliska proteiner..
Dess karakteristiska lukt gör den märkbar i ruttna ägg.
HtvåS produceras också i vissa industriella aktiviteter, såsom oljeraffinaderier, koksugnar, pappersbruk, garverier och vid livsmedelsbearbetning.
Syntes i däggdjursorganismen
HtvåEndogent S kan produceras i däggdjursvävnader, inklusive människor, genom två vägar, en enzymatisk och en icke-enzymatisk.
Den icke-enzymatiska vägen består av reduktionen av elementärt svavel S0 till HtvåS genom oxidation av glukos:
2 C6H12ELLER6 (glukos) + 6 S0 (svavel) + 3HtvåO → 3 C3H6ELLER3 + 6 timmartvåS + 3 COtvå (8)
Den enzymatiska vägen består av produktionen av HtvåS från L-cystein, som är en aminosyra som syntetiseras av kroppen. Processen säkerställs av flera enzymer, såsom cystationion-β-syntas och cystationion-y-lyas, bland andra..

Skaffas i laboratoriet eller industriellt
Vätgas (Htvå) och svavelelementet (S) reagerar inte vid normala omgivningstemperaturer, men ovanför dessa börjar de kombineras, varvid 310 ° C är den optimala temperaturen.
Processen är dock för långsam, så andra metoder används för att få den, inklusive följande.
Metallsulfider (såsom järnsulfid) reageras med syror (såsom saltsyra) i utspädd lösning.
FeS + 2 HCl → FeCltvå + HtvåS ↑ (9)
På detta sätt kan gasen HtvåS som, med tanke på dess toxicitet, måste samlas in säkert.
Industriell användning av HtvåS för att producera svavel
Lagring och transport i stora mängder HtvåDet är svårt att separera från naturgas genom aminskurning, så Claus-processen används för att omvandla den till svavel.

Två reaktioner inträffar i denna process. I den första HtvåS reagerar med syre för att ge SOtvå, som nämnts ovan (se reaktion 3).
Den andra är en järnoxidkatalyserad reaktion där SOtvå reduceras och HtvåS oxiderar och båda producerar svavel S (se reaktion 6).
På detta sätt erhålls svavel som lätt kan lagras och transporteras, såväl som avsedd för flera användningsområden..
Användbarhet eller betydelse av HtvåS endogen i kroppen
HtvåEndogen S är den som förekommer naturligt i kroppen som en del av normal metabolism hos människor, däggdjur och andra levande varelser.
Trots sitt långvariga rykte som en giftig och giftig gas som är förknippad med nedbrytningen av organiskt material, har flera nya studier från 2000-talet fram till idag fastställt att HtvåEndogen S är en viktig regulator för vissa mekanismer och processer i det levande varelsen.
HtvåS har hög lipofilicitet eller affinitet mot fetter, så det passerar lätt cellmembran och tränger igenom alla typer av celler.
Kardiovaskulära systemet
Hos däggdjur främjar eller reglerar vätesulfid en serie signaler som reglerar ämnesomsättning, hjärtfunktion och cellöverlevnad..
Det har en kraftfull effekt på hjärtat, blodkärlen och cirkulerande element i blodet. Modulerar cellmetabolism och mitokondriell funktion.
Försvarar njurarna från skador orsakade av ischemi.
Magtarmkanalen
Det spelar en viktig roll som en skyddande faktor mot skada på magslemhinnan. Det uppskattas att det kan vara en viktig medlare för gastrointestinal motilitet.
Det är sannolikt involverat i kontrollen av insulinsekretion.
Centrala nervsystemet
Det verkar också i viktiga funktioner i centrala nervsystemet och skyddar nervceller från oxidativ stress.
Det uppskattas att det kan skydda mot neurodegenerativa sjukdomar som Parkinsons, Alzheimers och Hungtintons sjukdom.
Visionsorgan
Skyddar retinal fotoreceptorceller från ljusinducerad degeneration.
Mot åldrande
HtvåEftersom det är en reducerande art kan den konsumeras av en mängd olika oxidationsmedel som cirkulerar i kroppen. Bekämpar oxiderande arter såsom reaktiva syrearter och reaktiva kvävearter i kroppen.
Begränsar fria radikala reaktioner genom aktivering av antioxidantenzymer som skyddar mot effekterna av åldrande.
Läkningspotential för HtvåS levereras exogent
Biotillgängligheten för HtvåEndogent S beror på vissa enzymer som är involverade i cysteinbiosyntes hos däggdjur.
Vissa studier tyder på att läkemedelsterapi med H-givaretvåS kan vara fördelaktigt för vissa patologier.
Till exempel kan det vara användbart hos diabetespatienter, eftersom det har observerats att blodkärlen hos diabetiska djur förbättras med läkemedel som tillför HtvåS exogent.
HtvåS som levereras exogent ökar angiogenes eller bildning av blodkärl, så det kan användas för behandling av kroniska ischemiska sjukdomar.
Läkemedel tas fram som kan frigöra HtvåS långsamt för att kunna agera positivt på olika sjukdomar. Effekten, säkerheten och mekanismerna för dess verkan har dock ännu inte undersökts..
Risker
HtvåS är ett dödligt gift om det inhaleras snyggt eller till och med utspädd 1 del gas i 200 delar luft. Fåglar är mycket känsliga för HtvåS och dö även i utspädning av 1 på 1500 delar luft.

HtvåS är en potent hämmare av vissa enzymer och oxidativa fosforyleringsprocesser, vilket leder till cell kvävning. De flesta luktar det i koncentrationer större än 5 ppb (delar per miljard). Koncentrationer på 20-50 ppm (delar per miljon) irriterar ögonen och andningsorganen.
En inandning av 100-250 ppm under några minuter kan orsaka inkoordination, minnesstörningar och motoriska störningar. När koncentrationen är cirka 150-200 ppm uppträder luktutmattning eller anosmi, vilket innebär att den karakteristiska lukten av H efteråt inte kan detekteras.tvåS. Om en koncentration på 500 ppm inhaleras i 30 minuter kan lungödem och lunginflammation uppstå..
Koncentrationer på mer än 600 ppm kan vara dödliga inom de första 30 minuterna, eftersom andningsorganen är förlamad. Och 800 ppm är den koncentration som omedelbart är dödlig för människor..
Det bör därför undvikas att det finns läckor av HtvåS i laboratorier, lokaler eller på någon plats eller situation.
Det är viktigt att notera att många dödsfall inträffar eftersom människor går in i trånga utrymmen för att rädda medarbetare eller familjemedlemmar som har kollapsat på grund av H-förgiftning.tvåJa, passerar dem också.
Det är en brandfarlig gas.
Referenser
- Panthi, S. et al. (2016). Fysiologisk betydelse av vätesulfid: Emerging Potent Neuroprotector and Neuromodulator. Oxidativ medicin och cellulär livslängd. Volym 2016. Artikel-ID 9049782. Återställd från hindawi.com.
- Shefa, U. et al. (2018). Antioxidant- och cellsignaleringsfunktioner av vätesulfid i centrala nervsystemet. Oxidativ medicin och cellulär livslängd. Volym 2018. Artikel-ID 1873962. Återställd från hindawi.com.
- Tabassum, R. et al. (2020). Terapeutisk betydelse av vätesulfid vid åldersassocierade neurodegenerativa sjukdomar. Neural Regen Res 2020; 15: 653-662. Återställd från nrronline.org.
- Martelli, A. et al. (2010). Vätesulfid: ny möjlighet för läkemedelsupptäckt. Läkarundersökningar. Volym 32, nummer 6. Återställd från onlinelibrary.wiley.com.
- Wang, M.-J. et al. (2010). Mekanismer för angiogenes: Rollen av vätesulfid. Klinisk och experimentell farmakologi och fysiologi (2010) 37, 764-771. Återställd från onlinelibrary.wiley.com.
- Dalefield, R. (2017). Rök och andra inhalerade toxiska ämnen. Vätesulfid. Inom veterinärtoxikologi för Australien och Nya Zeeland. Återställd från sciencedirect.com.
- Selley, R.C. och Sonnenberg, S.A. (2015). De fysikaliska och kemiska egenskaperna hos petroleum. Vätesulfid. In Elements of Petroleum Geology (tredje upplagan). Återställd från sciencedirect.com.
- Hocking, M.B. (2005). Svavel och svavelsyra. Claus-processomvandling av vätesulfid till svavel. I Handbook of Chemical Technology and Pollution Control (tredje upplagan). Återställd från sciencedirect.com.
- Lefer, D.J. (2008). Potentiell betydelse av förändringar i vätesulfid (HtvåS) biotillgänglighet vid diabetes. British Journal of Pharmacology (2008) 155, 617-619. Återställd från bpspubs.onlinelibrary.wiley.com.
- USA National Library of Medicine. (2019). Vätesulfid. Återställd från: pubchem.ncbi.nlm.nih.gov.
- Babor, J.A. och Ibarz, J. (1965). Modern allmän kemi. 7: e upplagan. Ledare Marín, S.A.



Ingen har kommenterat den här artikeln än.