
Svavelsyra (H2SO4) Egenskaper, struktur och användningsområden
De svavelsyra (HtvåSW4) Det är en flytande, oljig och färglös kemisk förening, löslig i vatten med värmeutsläpp och frätande för metaller och tyger. Förkolnar trä och mest organiska material vid kontakt med det, men det är osannolikt att det orsakar brand.
Svavelsyra är kanske den viktigaste av alla tunga industriella kemikalier och dess konsumtion har citerats många gånger som en indikator på det allmänna tillståndet i en nations ekonomi..

Långvarig exponering för låga koncentrationer eller kortvarig exponering för höga koncentrationer kan leda till negativa hälsoeffekter. Den absolut viktigaste användningen av svavelsyra är inom fosfatgödselindustrin.
Andra viktiga tillämpningar är petroleumraffinering, pigmentproduktion, stålbejdning, extraktion av icke-järnmetaller och tillverkning av sprängämnen, rengöringsmedel, plast, konstgjorda fibrer och läkemedel..
Artikelindex
- 1 Vitriol, antecedenten av svavelsyra
- 2 Formel
- 3 Kemisk struktur
- 3.1 I 2D
- 3.2 I 3D
- 4 funktioner
- 4.1 Fysikaliska och kemiska egenskaper
- 4.2 Reaktioner med luft och vatten
- 4.3 Brännbarhet
- 4.4 Reaktivitet
- 4.5 Toxicitet
- 5 användningsområden
- 5.1 Indirekt
- 5.2 Direkt
- 6 Utvecklingen av svavelsyraindustrin
- 6.1 Vitriol-process
- 6.2 Blykammare
- 7 Aktuell produktion: kontaktprocess
- 7.1 Dubbelkontaktprocess
- 8 Råvaror som används vid produktion av svavelsyra
- 8.1 Pyrit
- 8.2 Svaveldioxid
- 8.3 Återvunnet
- 9 Kliniska effekter
- 10 Säkerhet och risker
- 10.1 GHS-faroklasser
- 10.2 Skyddsangivelsekoder
- 11 Referenser
Vitriol, antecedenten av svavelsyra
I medeltida Europa var svavelsyra känt som vitriol, vitriololja eller vitriollut av alkemister. Det ansågs vara den viktigaste kemiska substansen och försökte användas som en filosof.
Sumerierna hade redan en lista över olika typer av vitriol. Dessutom tog Galen, den grekiska läkaren Dioscorides och Plinius den äldre upp sin medicinska användning.

I hellenistiska alkemiska verk nämndes redan de metallurgiska användningarna av glasögonämnen. Vitriol är en grupp glasögonmineraler från vilka svavelsyra kan erhållas.
Formel
-Formel: HtvåSW4
-CAS-nummer: 7664-93-9
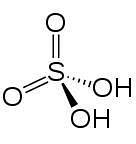
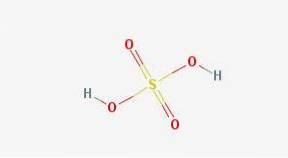
Kemisk struktur
I 2D
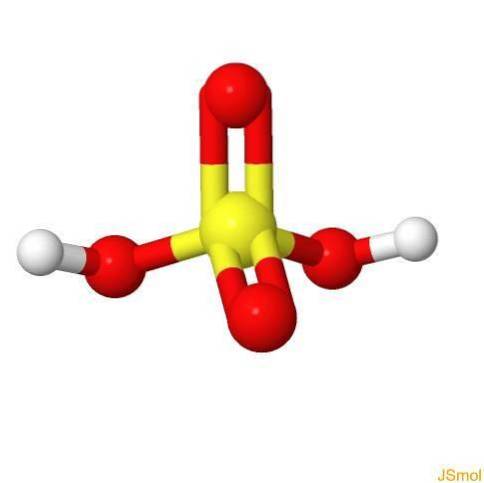
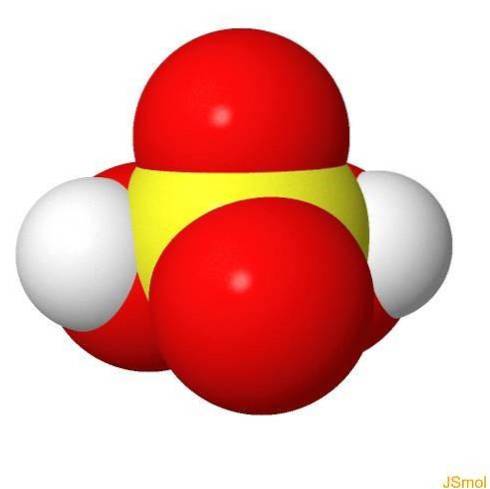
I 3d
Egenskaper
Fysiska och kemiska egenskaper

Svavelsyra tillhör den reaktiva gruppen av starka oxiderande syror.
Reaktioner med luft och vatten
- Reaktionen med vatten är försumbar såvida inte surheten är över 80-90%, då är hydrolysvärmen extrem, det kan orsaka allvarliga brännskador.
Eldfarlighet
- Starka oxiderande syror är i allmänhet icke brandfarliga. De kan påskynda förbränningen av andra material genom att tillföra syre till förbränningsstället.
- Svavelsyra är emellertid mycket reaktiv och kan antända finfördelade brännbara material vid kontakt med dem..
- Vid uppvärmning avger den mycket giftiga ångor.
- Det är explosivt eller oförenligt med ett stort antal ämnen.
- Kan genomgå våldsamma kemiska förändringar vid höga temperaturer och tryck.
- Kan reagera våldsamt med vatten.
Reaktivitet
- Svavelsyra är starkt sur.
- Reagerar våldsamt med brompentafluorid.
- Explodera med paranitrotoluen vid 80 ° C.
- En explosion inträffar när koncentrerad svavelsyra blandas med kristallint kaliumpermanganat i en behållare som innehåller fukt. Manganheptoxid bildas som exploderar vid 70 ° C.
- Blandningen av akrylnitril med koncentrerad svavelsyra måste hållas väl kyld, annars inträffar en kraftig exoterm reaktion.
- Temperaturen och trycket ökar när svavelsyra (96%) blandas i lika delar i en sluten behållare med något av följande ämnen: acetonitril, akrolein, 2-aminoetanol, ammoniumhydroxid (28%), anilin, n-butyraldehyd, klorsulfon syra, etylendiamin, etylenimin, epiklorhydrin, etylencyanohydrin, saltsyra (36%), fluorvätesyra (48,7%), propylenoxid, natriumhydroxid, styrenmonomer.
- Svavelsyra (koncentrerad) är extremt farlig vid kontakt med karbider, bromater, klorater, grundfärger, pikrater och pulverformiga metaller..
- Kan framkalla våldsam polymerisation av allylklorid och reagerar exotermiskt med natriumhypoklorit för att producera klorgas.
- Blandning av klorsvavelsyra och 98% svavelsyra ger HCl.
Giftighet
- Svavelsyra är frätande för alla vävnader i kroppen. Inandning av ånga kan orsaka allvarliga lungskador. Kontakt med ögonen kan leda till total synförlust. Kontakt med huden kan orsaka allvarlig nekros.
- Att svälja svavelsyra, i en mängd mellan 1 tesked och en halv uns av den koncentrerade kemikalien, kan vara dödlig för en vuxen. Även några droppar kan vara dödliga om syran kommer in i luftröret.
- Kronisk exponering kan orsaka trakeobronchit, stomatit, konjunktivit och gastrit. Gastrisk perforering och peritonit kan förekomma och kan följas av cirkulationskollaps. Cirkulationsstöt är ofta den omedelbara dödsorsaken.
- De med kroniska luftvägs-, mag-tarm- eller nervsjukdomar och ögon- och hudsjukdomar löper ökad risk.
Applikationer
- Svavelsyra är en av de mest använda industriella kemikalierna i världen. Men de flesta av dess användningsområden kan betraktas som indirekt och kan delta som ett reagens snarare än som en ingrediens.
- Det mesta av svavelsyran hamnar som den syra som används i produktionen av andra föreningar eller som någon typ av sulfatrester.
- Ett antal produkter innehåller svavel eller svavelsyra, men nästan alla är speciella lågvolymsprodukter..
- Cirka 19% av svavelsyran som producerades 2014 konsumerades i ett tjugotal kemiska processer, och resten konsumerades i en mängd olika industriella och tekniska applikationer..
- Ökningen i efterfrågan på svavelsyra över hela världen beror i minskande ordning på produktionen av: fosforsyra, titandioxid, fluorvätesyra, ammoniumsulfat och uranbearbetning och metallurgiska tillämpningar.
Indirekt
- Den största konsumenten av svavelsyra är överlägset gödselindustrin. Den representerade drygt 58% av den totala världskonsumtionen 2014. Denna andel förväntas dock minska till cirka 56% till 2019, främst till följd av högre tillväxt inom andra kemiska och industriella tillämpningar..
- Produktionen av fosfatgödselmaterial, särskilt fosforsyra, är huvudmarknaden för svavelsyra. Det används också för tillverkning av gödningsmedelsmaterial såsom trippel superfosfat och mono- och diammoniumfosfater. Mindre kvantiteter används för produktion av superfosfat och ammoniumsulfat.
- I andra industriella tillämpningar används väsentliga mängder svavelsyra som ett syra-dehydratiseringsreaktionsmedium, i organisk kemi och petrokemiska processer som involverar reaktioner såsom nitrering, kondensation och dehydrering, såväl som vid petroleumraffinering, där den används i raffinering, alkylering och rening av rå destillat.
- Inom den oorganiska kemiska industrin är dess användning anmärkningsvärd vid produktion av TiO2-pigment, saltsyra och fluorvätesyra..
- Inom metallbearbetningsindustrin används svavelsyra för betning av stål, urlakning av koppar, uran och vanadinmalmer vid hydrometallurgisk bearbetning av mineraler och för beredning av elektrolytiska bad för rening och plätering av metaller. järn-.
- Vissa processer för tillverkning av vedmassa i pappersindustrin, vid tillverkning av vissa textilier, vid tillverkning av kemiska fibrer och garvning av hudar kräver också svavelsyra.
Direkt
- Förmodligen är den största användningen av svavelsyra, där svavel införlivas i slutprodukten, i den organiska sulfoneringsprocessen, särskilt för produktion av tvättmedel..
- Sulfonering spelar också en viktig roll för att erhålla andra organiska kemikalier och mindre läkemedel..
- Blybatterier är en av de mest kända svavelsyrainnehållande konsumentprodukterna och står för endast en liten del av den totala svavelsyraförbrukningen..
- Under vissa förhållanden används svavelsyra direkt i jordbruket för rehabilitering av starkt alkaliska jordar, såsom de som finns i ökenregionerna i västra USA. Denna användning är emellertid inte särskilt viktig när det gäller den totala volymen svavelsyra som används..
Utvecklingen av svavelsyraindustrin
Vitriol-processen

Den äldsta metoden för att erhålla svavelsyra är den så kallade "vitriolprocessen", som är baserad på termisk nedbrytning av vitrioler, som är sulfater av olika slag, av naturligt ursprung..
De persiska alkemisterna, Jābir ibn Hayyān (även känd som Geber, 721 - 815 e.Kr.), Razi (865 - 925 e.Kr.) och Jamal Din al-Watwat (1318 e.Kr.), inkluderade vitriol i sina mineralklassificeringslistor.
Det första omnämnandet av "vitriolprocessen" framgår av Jabir ibn Hayyans skrifter. Sedan beskrev alkemisterna St. Albert den store och Basilius Valentinus processen mer detaljerat. Alun och kalktitit (blå vitriol) användes som råmaterial.
I slutet av medeltiden erhölls svavelsyra i små mängder i glasbehållare, där svavel brändes med saltpeter i en fuktig miljö..
Vitriolprocessen användes i industriell skala från 1500-talet på grund av en större efterfrågan på svavelsyra.
Vitriol av Nordhausen
Produktionsfokus var i den tyska staden Nordhausen (varför vitriolen började kallas "Nordhausen vitriol"), där järn (II) sulfat (grön vitriol, FeSO4 - 7HtvåO) som råmaterial, som upphettades och den resulterande svaveltrioxiden blandades med vatten för att erhålla svavelsyra (olja av vitriol).
Processen genomfördes i köpar, varav några hade flera nivåer, parallellt för att erhålla större mängder vitriololja..
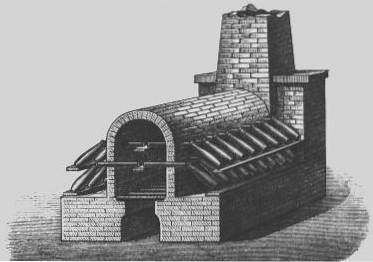
Lead Chambers
På 1700-talet utvecklades en mer ekonomisk process för produktion av svavelsyra, känd som "blykammarprocessen".
Fram till dess var den maximala koncentrationen av syra som erhölls 78%, medan med "vitriolprocessen" erhölls koncentrerad syra och oleum, så denna metod fortsatte att användas i vissa sektorer av industrin fram till "kontaktprocessen". 1870, med vilken koncentrerad syra kunde erhållas billigare.
Oleum eller rökande svavelsyra (CAS: 8014-95-7), är en lösning med oljig konsistens och mörkbrun färg, med en variabel sammansättning av svaveltrioxid och svavelsyra, som kan beskrivas med formeln HtvåSW4.xSO3 (där x representerar det fria molära innehållet av svaveloxid (VI)). Ett värde för x av 1 ger den empiriska formeln HtvåStvåELLER7, motsvarande disulfuric acid (eller pyrosulfuric acid).
Bearbeta
Blykammarprocessen var den industriella metoden som användes för att producera svavelsyra i stora mängder innan den ersattes av "kontaktprocessen".
1746 i Birmingham, England, började John Roebuck producera svavelsyra i blyfodrade kammare, som var starkare och billigare än tidigare använda glasbehållare och kunde göras mycket större.
Svaveldioxid (från förbränningen av elementärt svavel eller metalliska mineraler innehållande svavel, såsom pyrit) infördes med ånga och kväveoxid i stora kammare fodrade med blyark..
Svaveldioxiden och kvävedioxiden löstes upp och under en period av cirka 30 minuter oxiderades svaveldioxiden till svavelsyra..
Detta möjliggjorde en effektiv industrialisering av svavelsyraproduktionen, och med olika förfiningar förblev denna process standardproduktionsmetod i nästan två århundraden..
År 1793 uppnådde Clemente och Desormes bättre resultat genom att införa extra luft i blykammarprocessen..
1827 introducerade Gay-Lussac en metod för att absorbera kväveoxider från avgaserna i blykammaren..
1859 utvecklade Glover en metod för utvinning av kväveoxider från nybildad syra genom strippning med heta gaser, vilket gjorde det möjligt att genomföra kväveoxidkatalyseringsprocessen kontinuerligt..
År 1923 introducerade Petersen en förbättrad tornprocess som gjorde det möjligt att konkurrera med kontaktprocessen fram till 1950-talet..
Kammarprocessen blev så robust att den 1946 fortfarande representerade 25% av världens svavelsyraproduktion..
Aktuell produktion: kontaktprocess
Kontaktprocessen är den nuvarande metoden för att producera svavelsyra i höga koncentrationer, nödvändig i moderna industriella processer. Platina var tidigare katalysatorn för denna reaktion. Emellertid föredras nu vanadinpentoxid (V2O5).
1831, i Bristol, England, patenterade Peregrine Phillips oxidationen av svaveldioxid till svaveltrioxid med en platinakatalysator vid förhöjda temperaturer..
Antagandet av hans uppfinning och den intensiva utvecklingen av kontaktprocessen började dock först efterfrågan på oleum för tillverkning av färgämne ökade från omkring 1872 och framåt..
Därefter undersöktes bättre fasta katalysatorer och kemin och termodynamiken i SO2 / SO3-jämvikten undersöktes..
Kontaktprocessen kan delas in i fem steg:
- Kombination av svavel och dioxygen (O2) för att bilda svaveldioxid.
- Rening av svaveldioxid i en reningsenhet.
- Tillsats av överskott av dioxygen till svaveldioxid i närvaro av vanadinpentoxidkatalysator, vid temperaturer av 450 ° C och ett tryck av 1-2 atm.
- Svaveltrioxiden som bildas tillsätts till svavelsyran som ger upphov till oleum (svavelsyra).
- Oleum tillsätts sedan till vattnet för att bilda svavelsyra som är högkoncentrerad..
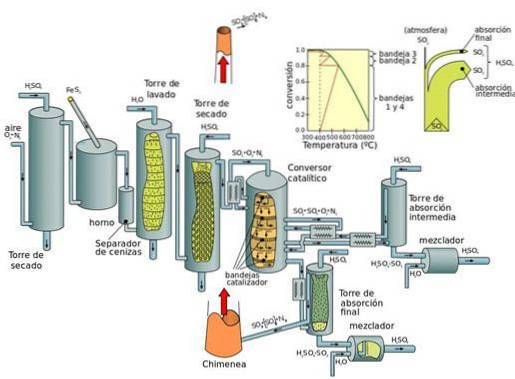
Den grundläggande nackdelen med kväveoxidprocesser (under blykammarprocessen) är att koncentrationen av svavelsyra som erhålls är begränsad till maximalt 70 till 75%, medan kontaktprocessen producerar koncentrerad syra (98%).
Med utvecklingen av relativt billiga vanadinkatalysatorer för kontaktprocessen, i kombination med det ökande behovet av koncentrerad svavelsyra, minskade den globala produktionen av svavelsyra i kväveoxidbehandlingsanläggningar stadigt..
År 1980 producerades nästan ingen syra i kväveoxidbearbetningsanläggningar i Västeuropa och Nordamerika.
Dubbelkontaktprocess
Dubbelabsorptionsprocessen med dubbelkontakt (DCDA eller Double Contact Double Absorption) införde förbättringar av kontaktprocessen för produktion av svavelsyra.
1960 ansökte Bayer om patent för den så kallade dubbelkatalysprocessen. Den första anläggningen som använde denna process startades 1964.
Genom att införliva ett SO-absorptionssteg3 Före de slutliga katalytiska stegen möjliggjorde den förbättrade kontaktprocessen en signifikant ökning av SO-omvandlingen.två , väsentligt minska utsläppen till atmosfären.
Gaserna ledes tillbaka genom den slutliga absorptionskolonnen och uppnår inte bara en hög SO-omvandlingsprestandatvå till SO3 (cirka 99,8%), men möjliggör också produktion av en högre koncentration av svavelsyra.
Den väsentliga skillnaden mellan denna process och den vanliga kontaktprocessen är i antalet absorptionssteg..
Från och med 1970-talet införde de viktigaste industriländerna strängare regler för miljöskyddet och den dubbla övertagandeprocessen blev mer utbredd i nya anläggningar. Den konventionella kontaktprocessen används dock fortfarande i många utvecklingsländer med mindre stränga miljöstandarder..
Den största drivkraften för den nuvarande utvecklingen av kontaktprocessen är fokuserad på att öka återvinningen och utnyttjandet av den stora mängden energi som produceras i processen..
Faktum är att en stor modern svavelsyraanläggning inte bara kan ses som en kemisk anläggning utan också som ett värmekraftverk..
Råvaror som används vid produktion av svavelsyra
Pyrit
Pyrit var det dominerande råmaterialet i produktionen av svavelsyra fram till mitten av 1900-talet, då stora mängder elementärt svavel började utvinnas från oljeraffineringsprocessen och rening av naturgas, vilket blev den viktigaste materialindustrins premie.
Svaveldioxid
För närvarande erhålls svaveldioxid med olika metoder, från olika råvaror.
I USA har industrin sedan början av 1900-talet varit baserad på att erhålla elementärt svavel från underjordiska avlagringar genom "Frasch-processen".
Måttligt koncentrerad svavelsyra produceras också genom återkoncentration och rening av stora mängder svavelsyra erhållen som en biprodukt från andra industriella processer..
Återvinning
Återvinning av denna syra blir allt viktigare ur miljösynpunkt, särskilt i de viktigaste utvecklade länderna..
Tillverkningen av svavelsyra baserad på elementärt svavel och pyrit är naturligtvis relativt känslig för marknadsförhållandena, eftersom syran som produceras av dessa material utgör en primär produkt..
Däremot, när svavelsyra är en biprodukt, tillverkad som ett medel för att avlägsna avfall från en annan process, dikteras nivån av dess produktion inte av förhållandena på svavelsyramarknaden utan av marknadsförhållandena för den primära produkten.
Kliniska effekter
-Svavelsyra används inom industrin och i vissa hushållsrengöringsprodukter, såsom badrumsrengöringsmedel. Används också i batterier.
-Medveten intag, särskilt av högkoncentrerade produkter, kan orsaka allvarliga skador och dödsfall. Dessa intagsexponeringar är sällsynta i USA, men förekommer i andra delar av världen..
-Det är en stark syra som orsakar vävnadsskador och proteinkoagulering. Det är frätande för huden, ögonen, näsan, slemhinnorna, andningsorganen och mag-tarmkanalen eller någon vävnad som den kommer i kontakt med..
-Skadans svårighetsgrad bestäms av koncentrationen och kontakttiden.
-Mildare exponeringar (koncentrationer mindre än 10%) orsakar endast irritation i huden, övre luftvägarna och mag-tarmslemhinnan.
-Andningseffekterna av akut exponering vid inandning inkluderar: irritation i näsa och hals, hosta, nysningar, reflexbronkospasm, dyspné och lungödem. Död kan inträffa av plötslig cirkulationsrubbning, glottisödem och luftvägsinvolvering eller akut lungskada.
-Förtäring av svavelsyra kan orsaka omedelbar epigastrisk smärta, illamående, salivation och kräkningar av slemhinnor eller blödande material som ser ut som "kaffesump". Ibland observeras kräkningar av färskt blod.
-Förtäring av koncentrerad svavelsyra kan leda till korrosion i matstrupen, nekros och perforering av matstrupen eller magen, särskilt i pyloren. Ibland ses skada på tunntarmen. Senare komplikationer kan inkludera stenos och fistelbildning. Efter intag kan metabolisk acidos utvecklas.
-Svåra hudbrännskador kan uppstå vid nekros och ärrbildning. Dessa kan vara dödliga om en tillräckligt stor yta på kroppsytan påverkas..
-Ögat är särskilt känsligt för korrosionsskador. Irritation, sönderrivning och konjunktivit kan utvecklas även med låga koncentrationer av svavelsyra. Stänk med svavelsyra i höga koncentrationer orsakar: hornhinneskador, synförlust och ibland perforering av världen.
-Kronisk exponering kan vara associerad med förändringar i lungfunktionen, kronisk bronkit, konjunktivit, emfysem, frekventa luftvägsinfektioner, gastrit, erosion av tandemaljen och eventuellt cancer i luftvägarna..
Säkerhet och risker
Faroangivelser från det globalt harmoniserade systemet för klassificering och märkning av kemikalier (GHS)
Det globalt harmoniserade systemet för klassificering och märkning av kemikalier (GHS) är ett internationellt överenskomet system, skapat av FN, utformat för att ersätta de olika klassificerings- och märkningsstandarder som används i olika länder genom att använda enhetliga kriterier på global nivå (Nations United, 2015 ).
Faroklasserna (och motsvarande GHS-kapitel), klassificerings- och märkningsstandarder och rekommendationer för svavelsyra är följande (European Chemicals Agency, 2017; FN, 2015; PubChem, 2017):
GHS-faroklasser
H303: Kan vara skadligt vid förtäring [Varning Akut toxicitet, oral - Kategori 5] (PubChem, 2017).
H314: Orsakar allvarliga brännskador på huden och ögonskador [Fara Frätning / irritation i huden - Kategori 1A, B, C] (PubChem, 2017).
H318: Orsakar allvarlig ögonskada [Fara Allvarlig ögonskada / ögonirritation - Kategori 1] (PubChem, 2017).
H330: Dödlig vid inandning [Risk Akut toxicitet, inandning - Kategori 1, 2] (PubChem, 2017).
H370: Orsakar organskador [Faraspecifik organtoxicitet, enstaka exponering - Kategori 1] (PubChem, 2017).
H372: Orsakar organskador genom långvarig eller upprepad exponering [Fara Specifik organtoxicitet, upprepad exponering - Kategori 1] (PubChem, 2017).
H402: Skadligt för vattenlevande organismer [Farligt för vattenmiljön, akut fara - Kategori 3] (PubChem, 2017).
Skyddsangivelsekoder
P260, P264, P270, P271, P273, P280, P284, P301 + P330 + P331, P303 + P361 + P353, P304 + P340, P305 + P351 + P338, P307 + P311, P310, P312, P314, P320, P3 P363, P403 + P233, P405 och P501 (PubChem, 2017).
Referenser
- Arribas, H. (2012) Diagram över produktion av svavelsyra med kontaktmetoden med pyrit som råvara [bild] Återställd från wikipedia.org.
- Handbok för kemisk ekonomi, (2017). Svavelsyra. Återställd från ihs.com.
- Handbok för kemisk ekonomi, (2017.) Världskonsumtion av svavelsyra - 2013 [bild]. Återställd från ihs.com.
- ChemIDplus, (2017). 3D-struktur av 7664-93-9 - Svavelsyra [bild] Hämtad från: chem.nlm.nih.gov.
- Codici Ashburnhamiani (1166). Porträtt av "Geber" från 1400-talet. Laurenziana Medicea-biblioteket [bild]. Återställd från wikipedia.org.
- Europeiska kemikaliemyndigheten (ECHA), (2017). Sammanfattning av klassificering och märkning. Harmoniserad klassificering - Bilaga VI till förordning (EG) nr 1272/2008 (CLP-förordningen).
- Databank för farliga ämnen (HSDB). TOXNET. (2017). Svavelsyra. Bethesda, MD, EU: National Library of Medicine. Återställd från: toxnet.nlm.nih.gov.
- Leyo (2007) Skelettformel för svavelsyra [bild]. Återställd från: commons.wikimedia.org.
- Liebigs Extract of Meat Company (1929) Albertus Magnus, Chimistes Celebres [bild]. Återställd från: wikipedia.org.
- Müller, H. (2000). Svavelsyra och svaveltrioxid. I Ullmanns Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag GmbH & Co. KGaA. Tillgänglig på: doi.org.
- FN (2015). Globalt harmoniserat system för klassificering och märkning av kemikalier (GHS) Sjätte reviderade utgåvan. New York, EU: FN: s publikation. Återställd från: unece.org.
- Nationellt centrum för bioteknikinformation. PubChem Compound Database, (2017). Svavelsyra - PubChem Structure. [image] Bethesda, MD, EU: National Library of Medicine. Återställd från: pubchem.ncbi.nlm.nih.gov.
- Nationellt centrum för bioteknikinformation. PubChem Compound Database, (2017). Svavelsyra. Bethesda, MD, EU: National Library of Medicine. Återställd från: pubchem.ncbi.nlm.nih.gov.
- National Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Kemiskt datablad. Svavelsyra, förbrukad. Silver Spring, MD. EU; Återställd från: cameochemicals.noaa.gov.
- National Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Kemiskt datablad. Svavelsyra. Silver Spring, MD. EU; Återställd från: cameochemicals.noaa.gov.
- National Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Datablad för reaktiv grupp. Syror, starkt oxiderande. Silver Spring, MD. EU; Återställd från: cameochemicals.noaa.gov.
- Oelen, W. (2011) Svavelsyra 96 procent extra ren [bild]. Återställd från: wikipedia.org.
- Oppenheim, R. (1890). Schwefelsäurefabrik nach dem Bleikammerverfahren in der zweiten Hälfte des 19. Lehrbuch der Technischen Chemie [bild]. Återställd från: wikipedia.org.
- Priesner, C. (1982) Johann Christian Bernhardt und die Vitriolsäure, i: Chemie in unserer Zeit. [bild]. Återställd från: wikipedia.org.
- Stephanb (2006) Kopparsulfat [bild]. Återställd från: wikipedia.org.
- Stolz, D. (1614) Alkemiskt diagram. Theatrum Chymicum [bild] Återställd från: wikipedia.org.
- Wikipedia, (2017). Svavelsyra. Återställd från: wikipedia.org.
- Wikipedia, (2017). Svavelsyra. Återställd från: wikipedia.org.
- Wikipedia, (2017). Bleikammerverfahren. Återställd från: wikipedia.org.
- Wikipedia, (2017). Kontaktprocess. Återställd från: wikipedia.org.
- Wikipedia, (2017). Blykammarprocess. Återställd från: wikipedia.org.
- Wikipedia, (2017). Oleum. Återställd från: https://en.wikipedia.org/wiki/Oleum
- Wikipedia, (2017). Oleum. Återställd från: https://es.wikipedia.org/wiki/%C3%93leum
- Wikipedia, (2017). Svaveloxid Återställd från: wikipedia.org.
- Wikipedia, (2017). Vitriol-processen. Återställd från: wikipedia.org.
- Wikipedia, (2017). Svaveldioxid. Återställd från: wikipedia.org.
- Wikipedia, (2017). Svaveltrioxid. Återställd från: wikipedia.org.
- Wikipedia, (2017). Svavelsyra. Återställd från: wikipedia.org.
- Wikipedia, (2017). Vitriolverfahren. Återställd från: wikipedia.org.
- Wright, J. (1770) Alchymisten, på jakt efter filosofens sten, upptäcker fosfor och ber för en framgångsrik avslutning av hans operation, som vanliga chymiska astrologernas sed var. [bild] Återställd från: wikipedia.org.

Ingen har kommenterat den här artikeln än.