
Jodsyra (HIO3) struktur, egenskaper, risker och användningar

De jodsyra är en oorganisk förening med formeln HIO3. Det är en oxsyra av jod, som har ett oxidationstillstånd på +5 i denna molekyl. Denna förening är en mycket stark syra och används ofta för att standardisera lösningar av svaga och starka baser för att förbereda dem för titreringar..
Den bildas genom att oxidera diatomisk jod med salpetersyra, klor, väteperoxid eller saltsyra såsom visas i följande reaktion: Itvå + 6HtvåO + 5Cltvå H 2HIO3 + 10HCl.
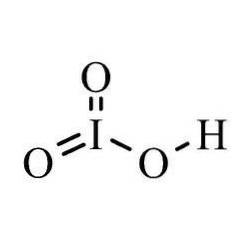
I varje reaktion förlorar diatomisk jod elektroner och bildar ett komplex med väte och syre. På grund av dess joniska och lösliga egenskaper är jonsyra också en mycket stark syra..
Artikelindex
- 1 Fysikaliska och kemiska egenskaper hos jodsyra
- 2 Reaktivitet och faror
- 3 Användningar och hälsofördelar
- 4 Referenser
Fysikaliska och kemiska egenskaper hos jodsyra
Jodsyra är ett vitt fast ämne vid rumstemperatur (Royal Society of Chemistry, 2015).

Jodsyra har en molekylvikt på 175,91 g / mol och har en densitet på 4,62 g / ml. Det är mycket lösligt i vatten och kan lösa upp 269 gram syra per 100 ml. Dess smältpunkt är 110 grader Celsius, där den börjar sönderdelas uttorkande till jodpentoxid.
Med efterföljande uppvärmning av föreningen till en högre temperatur sönderdelas den för att ge en blandning av jod, syre och lägre jodoxider (National Center for Biotechnology Information, S.F.).
Det är en relativt stark syra med en surhet på 0,75. Jod- eller jodidjonen är produkten av denna förening när den oxideras. Vid mycket lågt pH och hög kloridjonkoncentration reduceras den till jodtriklorid som är en gul förening i lösning.
Reaktivitet och faror
Jodsyra är en stabil förening under vanliga förhållanden. Eftersom det är en stark syra är det extremt farligt vid hudkontakt (frätande och irriterande), kontakt med ögonen (irriterande) och vid förtäring. Dessutom är det mycket farligt även vid inandning (JODSYRA, S.F.).
Mängden vävnadsskada beror på kontaktens längd. Kontakt med ögonen kan leda till hornhinneskador eller blindhet. Kontakt med huden kan orsaka inflammation och blåsor. Inandning av damm kommer att orsaka irritation i mag-tarmkanalen eller luftvägarna, som kännetecknas av sveda, nysningar och hosta..
Allvarlig överexponering kan orsaka lungskador, kvävning, medvetslöshet eller dödsfall. Långvarig exponering kan orsaka brännskador och sår på huden. Överexponering vid inandning kan orsaka irritation i andningsorganen..
Inflammation i ögat kännetecknas av rodnad, vattning och klåda. Inflammation i huden kännetecknas av klåda, skalning, rodnad eller ibland blåsor.
Ämnet är giftigt för njurar, lungor och slemhinnor.
Upprepad eller långvarig exponering för ämnet kan orsaka skador på dessa organ och irritation i ögonen. Periodisk exponering för huden kan orsaka lokal förstörelse av huden eller dermatit..
Upprepad inandning av damm kan ge varierande grad av irritation i luftvägarna eller lungskador. Långvarig inandning av damm kan orsaka kronisk irritation i luftvägarna..
Vid kontakt med ögonen, kontrollera om du har kontaktlinser och ta bort dem omedelbart. Ögonen ska sköljas med rinnande vatten i minst 15 minuter, hålla ögonlocken öppna och kunna använda kallt vatten. Ögonsalva ska inte användas.
Om kemikalien kommer i kontakt med kläder ska du ta bort den så snabbt som möjligt och skydda dina egna händer och kropp. Placera offret under en säkerhetsdusch.
Om kemikalien ackumuleras på utsatt hud, t.ex. händer, tvättas den förorenade huden försiktigt och försiktigt med rinnande vatten och icke-slipande tvål. Om irritation kvarstår, kontakta läkare och tvätta förorenade kläder innan de återanvänds..
Om hudkontakten är svår bör den tvättas med ett desinfektionsmedel och tvätta den förorenade huden med en antibakteriell kräm..
Vid inandning ska offret tillåtas vila i ett väl ventilerat område. Om inandning är svår bör offret evakueras till ett säkert område så snart som möjligt och täta kläder (skjortkrage, bälten eller slips) ska lossas..
Om offret har svårt att andas bör syre ges. I extrema fall av att inte andas utförs återupplivning från mun till mun. Naturligtvis måste man ta hänsyn till att det kan vara farligt för den person som ger hjälp när det inandade materialet är giftigt, smittsamt eller frätande..
Vid förtäring, framkalla inte kräkning, lossa kläderna och om personen inte andas, utför återupplivning från mun till mun.
I samtliga fall bör omedelbar läkarvård sökas (säkerhetsdatablad jodsyra, 2013).
Användningar och hälsofördelar
Jodsyra används vanligtvis som standardiseringsmedel för lösningar av svaga och starka baser. Det är en stark syra som används i analytisk kemi för att utföra titreringar.
Används med metylröda eller metylorange indikatorer för att utföra ekvivalensavläsningar i titreringar.
Det används i saltindustrin för att syntetisera natrium- eller kaliumjodatsalt. Genom att använda denna jodsyraförening vid framställningen av saltet ökar jodhalten i saltet (Omkar Chemicals, 2016).
Denna förening har länge använts för organisk syntes eftersom den har förmågan att selektivt oxidera organiska föreningar, med tanke på dess verkan att utföra motsvarande partiell oxidationsanalys, en användbar teknik för att bestämma strukturer (Roger J. Williams, 1937).
Jod och jodsyra används som en effektiv kombination av reagens för jodering av arylhydroxiketoner. I arbetet med (Bhagwan R. Patila, 2005) jodinerades en mängd olika orto-hydroxisubstituerade aromatiska karbonylföreningar med jod och jodsyra med utmärkta utbyten..
Referenser
- Bhagwan R. Patila, S. R. (2005). Jod och jodsyra: en effektiv reagenskombination för jodering av arylhydroxiketoner. Tetrahedron Letters Volym 46, nummer 42, 7179-7181. arkat-usa.org.
- JODSYRA. (S.F.). Hämtad från chemicalland21: chemicalland21.com.
- Säkerhetsdatablad Jodsyra. (2013, 21 maj). Hämtad från sciencelab: sciencelab.com.
- Nationellt centrum för bioteknikinformation. (S.F.). PubChem Compound Database; CID = 24345. Hämtad från PubChem.
- Omkar Chemicals. (2016, 11 juni). JODSYRANS NATUR OCH DENAS ANVÄNDNING I MÅNGLIGA SYFTE. Hämtad från Omkar Chemicals officiella blogg: omkarchemicals.com.
- Roger J. Williams, M. A. (1937). VAL AV JODSYRA I OXIDERING AV ORGANISKA FÖRENINGAR. journal of american chemical society 59 (7), 1408-1409.
- Royal Society of Chemistry. (2015). Jodsyra. Hämtad från chemspider: chemspider.com.



Ingen har kommenterat den här artikeln än.