
Klorhistoria, egenskaper, struktur, risker, användningar
De klor Det är ett kemiskt grundämne som representeras av symbolen Cl. Det är den andra av halogenerna, belägen under fluor, och är också det tredje mest elektronegativa elementet av alla. Dess namn härstammar från sin gulgröna färg, som är mer intensiv än fluor.
Populärt, när någon hör ditt namn är det första de tänker på blekningsprodukter för kläder och vattnet i simbassänger. Även om klor fungerar effektivt i sådana exempel är det inte dess gas utan dess föreningar (särskilt hypoklorit) som utövar bleknings- och desinfektionsverkan..

Bilden ovan visar en rund kolv med klorgas. Dess densitet är större än luftens, vilket förklarar varför den förblir i kolven och inte flyr ut i atmosfären. som det händer med andra lättare gaser, för att säga helium eller kväve. I detta tillstånd är det en mycket giftig substans, eftersom den producerar saltsyra i lungorna..
Det är därför som elementärt eller gasformigt klor inte har många användningsområden, förutom i vissa synteser. Emellertid täcker dess föreningar, vare sig de är salter eller klorerade organiska molekyler, en bra användarrepertoar, som går längre än simbassänger och extremt vita kläder..
På samma sätt finns dess atomer i form av kloridanjoner i våra kroppar och reglerar nivåerna av natrium, kalcium och kalium, liksom i magsaft. Annars skulle natriumkloridintaget vara ännu mer dödligt.
Klor produceras genom elektrolys av saltlösning, rik på natriumklorid, en industriell process där även natriumhydroxid och väte erhålls. Och eftersom haven är en nästan outtömlig källa till detta salt är de potentiella reserverna för detta element i hydrosfären mycket stora..
Artikelindex
- 1 Historia
- 1.1 Första tillvägagångssätt
- 1.2 Upptäckt
- 1.3 Oxymuratisk syra
- 1.4 Erkännande som ett element
- 2 Fysikaliska och kemiska egenskaper
- 2.1 Fysiskt utseende
- 2.2 Atomnummer (Z)
- 2.3 Atomvikt
- 2.4 Kokpunkt
- 2.5 Smältpunkt
- 2.6 Densitet
- 2.7 Fusionsvärme
- 2.8 Förångningsvärme
- 2.9 Molär värmekapacitet
- 2.10 Löslighet i vatten
- 2.11 Ångtryck
- 2.12 Elektronegativitet
- 2.13 Joniseringsenergier
- 2.14 Värmeledningsförmåga
- 2.15 Isotoper
- 2.16 oxidationsnummer
- 3 Struktur och elektronisk konfiguration
- 3.1 Klormolekyl
- 3.2 Intermolekylära interaktioner
- 4 Var att hitta och få
- 4.1 Kloridsalter
- 4.2 Elektrolys av saltlösning
- 4.3 Syraupplösning av pyrolusit
- 5 legeringar
- 6 risker
- 7 användningsområden
- 7.1 Syntes
- 7.2 Biologiska ämnen
- 7.3 Kemiska vapen
- 7.4 Desinfektionsmedel
- 7.5 Blekmedel
- 7.6 Polyvinylklorid
- 8 Referenser
Berättelse
Första tillvägagångssättet
På grund av den höga reaktiviteten hos klorgas, antog antika civilisationer aldrig dess existens. Emellertid var dess föreningar en del av mänsklighetens kultur sedan urminnes tider; dess historia började kopplas till vanligt salt.
Å andra sidan uppstod klor från vulkanutbrott och när någon upplöste guld i vattenregioner; Men ingen av de första metoderna räckte ens för att formulera tanken att den gulgröna gasen var ett element eller en förening.
Upptäckt
Upptäckten av klor tillskrivs den svenska kemisten Carl Wilhelm Scheele, som 1774 genomförde reaktionen mellan mineralen pyrolusit och saltsyra (då kallad muriatsyra).
Scheele får krediten eftersom han var den första forskaren som studerade klorns egenskaper; även om det tidigare erkänts (1630) av Jan Baptist van Helmont.
Experimenten som Scheele fick sina observationer med är intressanta: han utvärderade klorens blekande verkan på rödaktiga och blåaktiga kronblad av blommor, liksom på blad av växter och insekter som dog omedelbart..
På samma sätt rapporterade han att den är mycket reaktiv för metaller, dess kvävande lukt och oönskade effekt på lungorna och att när den löstes i vatten ökade dess surhet..
Oxymuratisk syra
Då betraktade kemister alla föreningar som hade syre som en syra; så de tänkte felaktigt att klor måste vara en gasformig oxid. Det är så de kallade det '' oxymuratisk syra '' (muriatisk syraoxid), ett namn som myntades av den berömda franska kemisten Antoine Lavoisier.
1809 försökte Joseph Louis Gay-Lussac och Louis Jacques Thénard reducera denna syra med kol; reaktion med vilken de erhöll metaller från sina oxider. På det här sättet ville de extrahera det kemiska elementet i den förmodade oxymuratinsyran (som de kallade 'muriatsyra-deflogstiserad luft'.
Men Gay-Lussac och Thénard misslyckades i sina experiment; men de hade rätt att överväga möjligheten att den gulgröna gasen måste vara ett kemiskt grundämne och inte en förening.
Erkännande som ett element
Erkännandet av klor som ett kemiskt grundämne var tack vare Sir Humphry Davy, som 1810 genomförde sina egna experiment med kolelektroder och drog slutsatsen att en sådan oxid av muriatsyra inte fanns..
Och dessutom var det Davy som myntade namnet "klor" för detta element från det grekiska ordet "kloros", vilket betyder gulgrönt..
När de studerade klorens kemiska egenskaper befanns många av dess föreningar ha saltlösning. därför kallade de det en "halogen", vilket betyder saltbildare. Därefter användes termen halogen med de andra elementen i samma grupp (F, Br och I).
Michael Faraday lyckades till och med smälta klor till ett fast ämne som på grund av att vara förorenat med vatten bildade hydratet CltvåHtvåELLER.
Resten av historien med klor är kopplad till dess desinfektionsmedel och blekningsegenskaper, fram till utvecklingen av den industriella processen med elektrolys av saltlösning för att producera stora mängder klor..
Fysiska och kemiska egenskaper
Fysiskt utseende
Det är en tät, ogenomskinlig, gulgrön gas med en irriterande sur lukt (en superförbättrad version av kommersiellt klor) och är också extremt giftig..
Atomnummer (Z)
17
Atomvikt
35,45 u.
Om inte annat anges motsvarar alla andra egenskaper mängder uppmätta för molekylklor, Cltvå.
Kokpunkt
-34,04 ºC
Smältpunkt
-101,5 ºC
Densitet
-Under normala förhållanden, 3,2 g / L
-Rätt vid kokpunkten 1,5624 g / ml
Observera att flytande klor är ungefär fem gånger så tät som dess gas. Dess ångdensitet är 2,49 gånger större än luftens. Det är därför som klor i den första bilden inte tenderar att fly från den runda kolven, eftersom den är tätare än luft den ligger längst ner. Denna egenskap gör den till en ännu farligare gas..
Fusionsvärme
6,406 kJ / mol
Förångningsvärme
20,41 kJ / mol
Molär värmekapacitet
33,95 J / (mol K)
Vattenlöslighet
1,46 g / 100 ml vid 0 ° C
Ångtryck
7,67 atm vid 25 ° C. Detta tryck är relativt lågt jämfört med andra gaser.
Elektronnegativitet
3.16 på Pauling-skalan.
Joniseringsenergier
-Först: 1251,2 kJ / mol
-Andra: 2298 kJ / mol
-Tredje: 3822 kJ / mol
Värmeledningsförmåga
8,9 10-3 W / (mK)
Isotoper
Klor förekommer i naturen främst som två isotoper: 35Cl, med ett överflöd på 76%, och 37Cl, med ett överflöd på 24%. Således är atomvikten (35,45 u) ett genomsnitt av atommassorna för dessa två isotoper, med deras respektive överflödsprocent..
Alla radioisotoper av klor är artificiella, bland vilka 36Cl som den mest stabila, med en halveringstid på 300 000 år.
Oxidationsnummer
Klor kan ha olika oxidationsnummer eller tillstånd när det är en del av en förening. Att vara en av de mest elektronegativa atomerna i det periodiska systemet har vanligtvis negativa oxidationsnummer; utom när det stöter på syre eller fluor, i vars oxider respektive fluorider det måste "förlora" elektroner.
I deras oxidationsnummer antas förekomsten eller närvaron av joner med samma laddningsstorlek. Således har vi: -1 (Cl-, den berömda kloridanjonen), +1 (Cl+), +2 (Cltvå+), +3 (Cl3+), +4 (Cl4+), +5 (Cl5+), +6 (Cl6+) och +7 (Cl7+). Av dem alla är -1, +1, +3, +5 och +7 de vanligaste som finns i klorerade föreningar..
Till exempel i ClF och ClF3 oxidationsnumren för klor är +1 (Cl+F-) och +3 (Cl3+F3-). I CltvåEller detta är +1 (Cltvå+ELLERtvå-); medan han var i ClOtvå, CltvåELLER3 och CltvåELLER7, är +4 (Cl4+ELLERtvåtvå-), +3 (Cltvå3+ELLER3två-) och +7 (Cltvå7+ELLER7två-).
I alla klorider har klor å andra sidan ett oxidationsnummer på -1; som i fallet med NaCl (Na+Cl-), där det är giltigt att säga att Cl finns- med tanke på saltets joniska natur.
Struktur och elektronisk konfiguration
Klormolekyl

Kloratomer i sitt marktillstånd har följande elektroniska konfiguration:
[Ne] 3stvå 3p5
Därför har var och en av dem sju valenselektroner. Om de inte är överbelastade med energi kommer det att finnas enskilda Cl-atomer i rymden, som gröna kulor. Emellertid är deras naturliga tendens att bilda kovalenta bindningar mellan dem för att fullborda sina valensoktetter..
Observera att de knappast behöver en elektron för att ha åtta valenselektroner, så de bildar en enkel enkel bindning; detta är den som förenar två Cl-atomer för att skapa Cl-molekylentvå (översta bilden), Cl-Cl. Det är därför klor under normala och / eller markbundna förhållanden är en molekylär gas; inte monatomiska, som med ädelgaser.
Intermolekylära interaktioner
Cl-molekylentvå det är homonukleärt och apolärt, så dess intermolekylära interaktioner styrs av Londons spridningskrafter och dess molekylmassor. I gasfasen är avståndet Cltvå-Cltvå den är relativt kort jämfört med andra gaser som, till sin massa, gör den till en gas tre gånger tätare än luft.
Ljus kan väcka och främja elektroniska övergångar inom Cltvå; följaktligen visas dess karakteristiska gulgröna färg. Denna färg intensifieras i flytande tillstånd och försvinner sedan delvis när den stelnar.
När temperaturen sjunker (-34 ° C), Cl-molekylernatvå förlorar kinetisk energi och avstånd Cltvå-Cltvå minskar; därför sammanfaller dessa och slutar med att definiera flytande klor. Samma sak händer när systemet kyls ännu mer (-101 ° C), nu med Cl-molekylernatvå så nära varandra att de definierar en ortorombisk kristall.
Det faktum att det finns klorkristaller är ett tecken på att deras spridningskrafter är tillräckligt riktade för att skapa ett strukturellt mönster; dvs molekylskikt av Cltvå. Separationen av dessa skikt är sådan att deras struktur inte ändras ens under ett tryck på 64 GPa, och de uppvisar inte heller elektrisk ledning..
Var att hitta och få
Kloridsalter

Klor i gasform kan inte hittas någonstans på jordytan, eftersom det är mycket reaktivt och tenderar att bilda klorider. Dessa klorider sprids väl genom jordskorpan och dessutom berikar de hav och hav efter miljontals år av att ha sköljts bort av regn..
Av alla klorider är NaCl för mineralhalit (övre bild) den vanligaste och rikligaste; följt av mineralerna silvin, KCl och karnalit, MgCltvåKCl 6HtvåO. När vattenmassor avdunstar på grund av solens verkan, lämnar de öknensalt sjöar, från vilka NaCl direkt kan extraheras som råmaterial för klorproduktion..
Elektrolys av saltlösning
NaCl löses i vatten för att producera en saltlösning (26%), som utsätts för elektrolys i en klor-alkalicell. Där sker två halvreaktioner i anod- och katodavdelningarna:
2Cl-(ac) => Cltvå(g) + 2e- (Anod)
2HtvåO (l) + 2e- => 2OH-(ac) + Htvå(g) (Katod)
Och den globala ekvationen för båda reaktionerna är:
2NaCl (aq) + 2HtvåO (l) => 2NaOH (aq) + Htvå(g) + Cltvå(g)
När reaktionen fortskrider, Na-jonerna+ bildas vid anoden migrerar in i katodutrymmet genom ett permeabelt asbestmembran. Av denna anledning är NaOH på höger sida av den globala ekvationen. Båda gaserna, Cltvå och Htvå, samlas upp från anoden respektive katoden.
Bilden nedan illustrerar vad som just skrevs:
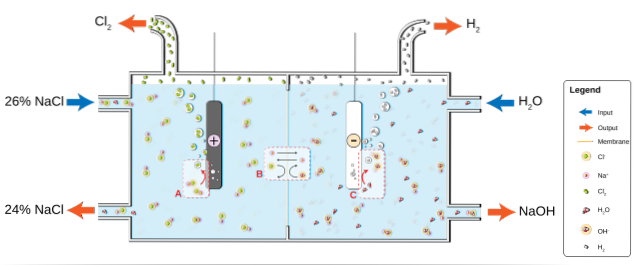
Observera att koncentrationen av saltlake i slutet minskar med 2% (den går från 24 till 26%), vilket innebär att en del av dess anjoner Cl- original transformerades till Cl-molekylertvå. I slutändan har industrialiseringen av denna process gett en metod för att producera klor, väte och natriumhydroxid.
Syraupplösning av pyrolusit
Som nämnts i historikavsnittet kan klorgas produceras genom att lösa pyrolusitmineralprover med saltsyra. Följande kemiska ekvation visar de produkter som erhållits från reaktionen:
MnOtvå(s) + 4HCl (aq) => MnCltvå(aq) + 2HtvåO (l) + Cltvå(g)
Legeringar
Klorlegeringar finns inte av två enkla skäl: deras gasformiga molekyler kan inte fångas mellan metallkristaller och de är också mycket reaktiva, så de skulle reagera omedelbart med metaller för att producera sina respektive klorider..
Å andra sidan är klorider inte heller önskvärda, eftersom de en gång upplöses i vatten och utövar en saltlösning som främjar korrosion i legeringar; och därför löses metaller för att bilda metallklorider. Korrosionsprocessen för varje legering är annorlunda; vissa är mer mottagliga än andra.
Klor är därför inte alls ett bra tillsatsmedel för legeringar; inte heller som Cltvå inte heller som Cl- (och Cl-atomer skulle vara mycket reaktiva så att de till och med kan existera).
Risker
Även om klorns löslighet i vatten är låg är det tillräckligt att producera saltsyra i fukten i vår hud och våra ögon, vilket slutar korrodera vävnaderna och orsaka allvarlig irritation och till och med synförlust..
Ännu värre är att andas sina gröngula ångor, eftersom det en gång i lungorna genererar syror igen och skadar lungvävnaden. Med detta upplever personen ont i halsen, hosta och andningssvårigheter på grund av vätskor som bildas i lungorna.
Om det finns ett klorläckage befinner du dig i en särskilt farlig situation: luften kan inte bara "svepa bort" dess ångor; de stannar där tills de reagerar eller långsamt sprids.
Utöver detta är det en starkt oxiderande förening, så att olika ämnen kan reagera explosivt med den vid minsta kontakt; precis som stålull och aluminium. Där klor lagras måste alla nödvändiga överväganden tas för att undvika brandrisk..
Ironiskt nog, medan klorgas är dödlig är dess kloranjon inte giftig; Det kan konsumeras (med måtta), det brinner inte och reagerar inte förutom med fluor och andra reagenser.
Applikationer
Syntes
Cirka 81% av den klorgas som produceras årligen används för syntes av organiska och oorganiska klorider. Beroende på graden av kovalens hos dessa föreningar kan klor återfinnas som enbart Cl-atomer i klorerade organiska molekyler (med C-Cl-bindningar) eller som Cl-joner- i några kloridsalter (NaCl, CaCltvå, MgCltvå, etc.).
Var och en av dessa föreningar har sina egna tillämpningar. Till exempel kloroform (CHCl3och etylklorid (CH3CHtvåCl) är lösningsmedel som har kommit att användas som inhalationsanestetika; diklormetan (CHtvåCltvå) och koltetraklorid (CCl4) är emellertid lösningsmedel som ofta används i organiska kemilaboratorier.
När dessa klorerade föreningar är flytande används de flesta gånger som lösningsmedel för organiska reaktionsmedier..
I andra föreningar representerar närvaron av kloratomer en ökning av dipolmomentet, så att de i större utsträckning kan interagera med en polär matris; en som består av proteiner, aminosyror, nukleinsyror, etc., biomolekyler. Således har klor också en roll i syntesen av läkemedel, bekämpningsmedel, insekticider, fungicider etc..
Beträffande oorganiska klorider används de vanligtvis som katalysatorer, råmaterial för att erhålla metaller genom elektrolys eller som källor till Cl-joner.-.
Biologisk
Det gasformiga eller elementära kloret har ingen roll i levande varelser än att förstöra deras vävnader. Detta betyder dock inte att dess atomer inte kan hittas i kroppen. Till exempel Cl-joner- är mycket rikliga i den cellulära och extracellulära miljön, och hjälper till att kontrollera nivåerna av Na-joner+ och Catvå+, till största del.
På samma sätt är saltsyra en del av magsaften som maten smälts i magen. dess Cl-joner-, i sällskap med H3ELLER+, definiera pH nära 1 av dessa utsöndringar.
Kemiska vapen
Tätheten av klorgas gör det till ett dödligt ämne när det spills eller hälls i slutna eller öppna utrymmen. Eftersom det är tätare än luft, bär en ström av det inte lätt klor, så det förblir en längre tid innan det slutligen sprids.
I första världskriget användes till exempel detta klor på slagfält. När han väl släpptes, smög han sig in i diken för att kväva soldaterna och tvinga dem till ytan..
Desinfektionsmedel

Klorerade lösningar, sådana där klorgas har lösts upp i vatten och sedan gjorts alkaliska med en buffert, har utmärkta desinfektionsegenskaper, såväl som hämmar vävnadsförrotning. De har använts för att desinficera öppna sår för att eliminera patogena bakterier.
Poolvatten är exakt klorerat för att eliminera bakterier, mikrober och parasiter som kan hamna i det. Tidigare användes klorgas för detta ändamål, men dess verkan är ganska aggressiv. Istället används natriumhypokloritlösningar (blekmedel) eller triklorisocyanursyra (TCA) -tabletter..
Ovan nämnda visar att det inte är Cltvå den som utövar desinfektionsverkan men HClO, hypokloritsyra, som producerar O-radikaler som förstör mikroorganismer.
Bleka
Mycket lik desinfektionsverkan blekar klor också material eftersom de färgämnen som är ansvariga för färgerna bryts ned av HClO. Således är dess klorerade lösningar idealiska för att ta bort fläckar från vita plagg eller för blekning av pappersmassa..
Polyvinylklorid
Den viktigaste klorföreningen av alla, som står för cirka 19% av återstående klorgasproduktion, är polyvinylklorid (PVC). Denna plast har flera användningsområden. Med den tillverkas vattenledningar, fönsterramar, vägg- och golvbeläggningar, elektriska ledningar, IV-påsar, rockar etc..
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Wikipedia. (2019). Klor. Återställd från: en.wikipedia.org
- Laura H. et al. (2018). Struktur av fast klor vid 1,45 GPaZeitschrift für Kristallographie. Kristallina material, volym 234, utgåva 4, sidorna 277-280, ISSN (online) 2196-7105, ISSN (tryck) 2194-4946, DOI: doi.org/10.1515/zkri-2018-2145
- Nationellt centrum för bioteknikinformation. (2019). Klor. PubChem-databas. CID = 24526. Återställd från: pubchem.ncbi.nlm.nih.gov
- Marques Miguel. (s.f.). Klor. Återställd från: nautilus.fis.uc.pt
- American Chemistry Council. (2019). Klorkemi: Introduktion till klor. Återställd från: chlorine.americanchemistry.com
- Fong-Yuan Ma. (S.f.). Frätande effekter av klorider på metaller. Institutionen för marinteknik, NTOU Republiken Kina (Taiwan).
- Delstaten New York. (2019). Fakta om klor. Återställd från: health.ny.gov
- Dr. Doug Stewart. (2019). Fakta om klorelement. Chemicool. Återställd från: chemicool.com



Ingen har kommenterat den här artikeln än.