
Klorbensen (C6H5Cl) Struktur, egenskaper, syntes
De klorbensen är en aromatisk förening med kemisk formel C6H5Cl, specifikt en aromatisk halogenid. Vid rumstemperatur är det en färglös, brandfarlig vätska, som ofta används som lösningsmedel och avfettningsmedel. Dessutom fungerar den som råvara för tillverkning av många mycket användbara kemiska föreningar..
Under det senaste århundradet fungerade det som grund för syntesen av insekticiden DDT, mycket användbar vid utrotning av sjukdomar som malaria. År 1970 förbjöds dess användning på grund av dess höga toxicitet för människor. Klorbensenmolekylen är polär på grund av en högre elektronegativitet av klor i förhållande till kolatomen till vilken den binder.
Detta resulterar i att klor har en måttlig densitet av negativ laddning δ- med avseende på kol och resten av den aromatiska ringen. På samma sätt är klorbensen praktiskt taget olösligt i vatten, men det är lösligt i vätskor av aromatisk kemisk natur, såsom: kloroform, bensen, aceton, etc..
Dessutom är Rhodococus phenolicus en bakterieart som kan bryta ned klorbensen som den enda kolkällan..
Artikelindex
- 1 Kemisk struktur
- 2 Kemiska egenskaper
- 2.1 Lukt
- 2.2 Molekylvikt
- 2.3 Kokpunkt
- 2.4 Smältpunkt
- 2.5 Flampunkt
- 2.6 Löslighet i vatten
- 2.7 Löslighet i organiska föreningar
- 2.8 Densitet
- 2.9 Ångdensitet
- 2.10 Ångtryck
- 2.11 Självantändning
- 2.12 Viskositet
- 2.13 Korrosivitet
- 2.14 Förbränningsvärme
- 2.15 Förångningsvärme
- 2.16 Ytspänning
- 2.17 Joniseringspotential
- 2.18 Lukttröskel
- 2.19 Experimentell fryspunkt
- 2.20 Stabilitet
- 3 Syntes
- 4 applikationer
- 4.1 Användningar i organisk syntes
- 4.2 Användning för syntes av organiska lösningsmedel
- 4.3 Läkemedelsanvändning
- 5 Referenser
Kemisk struktur
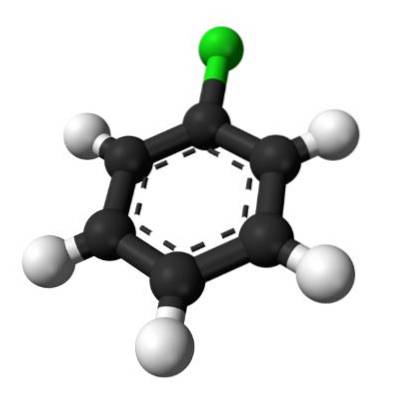
Den övre bilden illustrerar klorbensenstrukturen. De svarta kolsfärerna utgör den aromatiska ringen, medan de vita sfärerna och de gröna sfärerna utgör väte- och kloratomerna, motsvarande.
Till skillnad från bensenmolekylen har klorbensen ett dipolmoment. Detta beror på att Cl-atomen är mer elektronegativ än resten av sp-hybridiserade kol.två.
Av denna anledning finns det ingen enhetlig fördelning av elektrontätheten i ringen, men det mesta är riktat mot Cl-atomen..
Enligt denna förklaring kan det med en elektrontäthetskarta bekräftas att, även om det är svagt, finns det en region δ- rik på elektroner.
Följaktligen interagerar klorbensenmolekyler med varandra genom dipol-dipolkrafter. De är dock inte tillräckligt starka för att denna förening ska kunna existera i den fasta fasen vid rumstemperatur; av denna anledning är det en vätska (men med en högre kokpunkt än bensen).
Kemiska egenskaper
Odör
Dess lukt är mild, inte obehaglig och liknar mandel.
Molekylvikt
112,556 g / mol.
Kokpunkt
131,6 ° C (270 ° F) vid 760 mmHg tryck.
Smältpunkt
-45,2 ºC (-49 ºF)
Flampunkt
27 ºC (82 ºF)
Vattenlöslighet
499 mg / l vid 25 ºC.
Löslighet i organiska föreningar
Det är blandbart med etanol och etyleter. Det är mycket lösligt i bensen, koltetraklorid, kloroform och koldisulfid.
Densitet
1,1058 g / cm3 vid 20 ° C (1,11 g / cm3 vid 68 ° F). Det är en vätska som är lite tätare än vatten.
Ång-densitet
3,88 i förhållande till luft. 3,88 (luft = 1).
Ångtryck
8,8 mmHg vid 68 ° F; 11,8 mmHg vid 77 ° F; 120 mmHg vid 25 ºC.
Självantändning
593 ºC (1 099 ºC)
Viskositet
0,806 mPoise vid 20 ºC.
Korrosivitet
Angriper vissa typer av plast, gummi och vissa typer av beläggningar.
Förbränningsvärme
-3100 kJ / mol vid 25 ºC.
Förångningsvärme
40,97 kJ / mol vid 25 ºC.
Ytspänning
33,5 dyn / cm vid 20 ° C.
Joniseringspotential
9,07 eV.
Lukttröskel
Erkännande i luft 2.1.10-1 ppm. Lukt med låg lukt: 0,98 mg / cm3; hög lukt: 280 mg / cm3.
Experimentell fryspunkt
-45,55 ° C (-50 ° F).
Stabilitet
Det är oförenligt med oxidationsmedel.
Syntes
Inom industrin används metoden som infördes 1851, i vilken klorgas (Cltvå) genom den flytande bensen vid en temperatur av 240 ° C i närvaro av järnklorid (FeCl3), som fungerar som en katalysator.
C6H6 => C6H5Cl
Klorbensen framställs också från anilin i Sandmayer-reaktionen. Anilin bildar bensenediazoniumklorid i närvaro av natriumnitrit; och bensenediazoniumklorid bildar bensenklorid i närvaro av kopparklorid.
Applikationer
Användningar i organisk syntes
-Det används som ett lösningsmedel, avfettningsmedel och fungerar som råmaterial för framställning av många mycket användbara föreningar. Klorbensen användes vid syntesen av insekticiden DDT, som för närvarande inte används på grund av dess toxicitet för människa.
-Även om klorbensen i mindre grad används i syntesen av fenol, en förening som har en fungicid, bakteriedödande, insekticid, antiseptisk verkan och används också vid produktion av agrokemikalier, liksom vid tillverkningsprocessen av acetisalicylsyra..
-Det är involverat i tillverkningen av diisocyanat, ett avfettningsmedel för bildelar.
-Det används för att erhålla p-nitroklorbensen och 2,4-dinitroklorbensen.
-Den används vid syntes av föreningarna trifenylfosfin, tiofenol och fenylsilan.
-Trifenylfosfin används vid syntes av organiska föreningar; tiofenol är ett bekämpningsmedel och farmaceutisk mellanprodukt. Istället används fenylsilan i silikonindustrin.
-Det är en del av råmaterialet för tillverkning av difenyloxid, som används som värmeöverföringsmedel, vid bekämpning av växtsjukdomar och vid tillverkning av andra kemiska produkter..
-P-nitroklorbensen erhållen från klorbensen är en förening som används som mellanprodukt vid tillverkning av färgämnen, pigment, läkemedel (paracetamol) och i gummikemi.
Användning för syntes av organiska lösningsmedel
Klorbensen används också som råvara för tillverkning av lösningsmedel som används vid syntesreaktioner av organiska föreningar, såsom metylendifenyldiisocyanat (MDI) och uretan..
MDI är involverad i syntesen av polyuretan, som fyller många funktioner i tillverkningen av byggprodukter, kylskåp och frysar, sängmöbler, skor, bilar, beläggningar och lim och andra applikationer.
På samma sätt är uretan ett råmaterial för produktion av adjuvansföreningar för jordbruk, färger, bläck och rengöringslösningar för användning i elektronik..
Medicinsk användning
-2,4-dinitroklorbensen har använts i dermatologi vid behandling av alopecia areata. Det har också använts i allergistudier och i immunologin mot dermatit, vitiligo och i prognosen för utvecklingen hos patienter med malignt melanom, könsvårtor och vanliga vårtor..
-Det har haft terapeutisk användning hos patienter med HIV. Å andra sidan har det tillskrivits immunmodulerande funktioner, en aspekt som är föremål för diskussion..
Referenser
- Dra Alessandra B. Alió S. (1998). Dinitroklorbensen och dess tillämpningar. [PDF]. Venezuelansk dermatologi, VOL. 36, nr 1.
- Panoli Intermediates India Private Limited. Para-nitroklorobensen (PNCB). Hämtad den 4 juni 2018 från: panoliindia.com
- Korry Barnes. (2018). Klorbensen: Egenskaper, reaktivitet och användningar. Hämtad den 4 juni 2018 från: study.com
- Wikipedia. (2018). Klorbensen. Hämtad den 4 juni 2018 från: en.wikipedia.org
- PubChem. (2018). Klorbensen. Hämtad den 4 juni 2018 från: pubchem.ncbi.nlm.nih.gov



Ingen har kommenterat den här artikeln än.