
Litiumklorid (LiCl) egenskaper, risker och användningar
De Litiumklorid Det är en kemisk förening med formeln LiCl som kan framställas genom antändning av litium och klor, även om det är svårt eftersom reaktionen är våldsam. På detta sätt produceras den vattenfria formen (utan vatten). Litiumklorid kan också extraheras från andra alkalimetallklorider med amylalkohol..
Fram till 1990-talet dominerades metall- och litiummarknaden av amerikansk produktion från mineralfyndigheter. Men i början av 2000-talet härrörde huvuddelen av produktionen från icke-amerikanska källor, med Australien, Chile och Portugal som de viktigaste leverantörerna i världen..
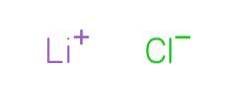
Som en nyfikenhet är det värt att notera att även om Bolivia har hälften av världens litiumfyndigheter är det inte en stor producent.
Den viktigaste kommersiella formen är litiumkarbonat, LitvåCO3, framställts av mineraler eller saltlösning genom flera olika processer.
Tillsatsen av saltsyra (HCl) ger litiumklorid. Med denna metod produceras den hydratiserade föreningen (vatten bunden till molekylen). Den hydratiserade formen kan torkas till den vattenfria formen genom upphettning med vätekloridgas..
Fysikaliska och kemiska egenskaper hos litiumklorid
Litiumklorid är ett vitt fast ämne utan speciell arom och salt smak (National Center for Biotechnology Information, 2005). Dess utseende visas i figur 2.

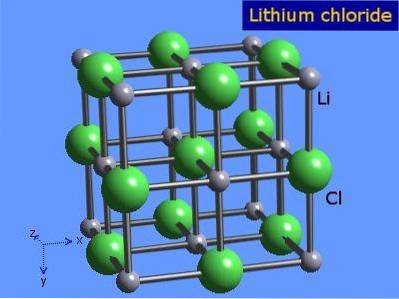
Litiumklorid är mycket hygroskopiska kristaller med oktaedrisk geometri som liknar natriumklorid. Dess kristallstruktur presenteras i figur 3 (Winter, S.F.).
Dess molekylvikt är 42,39 g / mol, densiteten är 2,068 g / ml och dess smält- och kokpunkter är 605 ° C respektive 1360 ° C..
Föreningen är mycket löslig i vatten, alkohol, eter, pyridin och nitrobensen (Royal Society of Chemistry, 2015).
Litiumklorid har svag oxiderande eller reducerande effekt. Redoxreaktioner kan dock fortfarande förekomma. Litiumkloridlösningar är i allmänhet varken starkt sura eller starkt basiska..
Eftersom det är extremt hygroskopiskt kan litiumklorid också absorbera upp till fyra ekvivalenter ammoniak per mol. Vattenhaltiga litiumkloridlösningar kan korrodera metaller (LITIUMKLORID, S.F.).
Reaktivitet och faror
Litiumklorid är en stabil förening som är oförenlig med starka oxidationsmedel, starka syror, bromtriklorid, bromtrifluorid.
Det är inte giftigt vid förtäring, men på grund av dess frätande natur kan det vara irriterande vid hudkontakt och ögon, det kan också irritera näsgångarna (National Institute for Occupational Safety and Health, 2015).
Vid kontakt med ögonen, kontrollera om du har kontaktlinser och ta bort dem omedelbart..
Ögonen ska spolas med rinnande vatten i minst 15 minuter och håll ögonlocken öppna. Kallt vatten kan användas. Ögonsalva ska inte användas.
Om kemikalien kommer i kontakt med kläder ska du ta bort den så snabbt som möjligt och skydda dina egna händer och kropp.
Placera offret under en säkerhetsdusch. Om kemikalien ansamlas på utsatt hud, t.ex. händer, tvättas den förorenade huden försiktigt och försiktigt med rinnande vatten och icke-slipande tvål..
Kallt vatten kan användas. Om irritation kvarstår, kontakta läkare. Tvätta de förorenade kläderna innan du använder dem igen.
Vid inandning ska offret tillåtas vila i ett väl ventilerat område. Om inandning är svår bör offret evakueras till ett säkert område så snart som möjligt..
Lossa trånga kläder som en skjortkrage, bälte eller slips. Om offret har svårt att andas bör syre ges.
Om offret inte andas utförs återupplivning från mun till mun. Tänk alltid på att det kan vara farligt för personen som ger hjälp att ge återupplivning från mun till mun när det inandade materialet är giftigt, smittsamt eller frätande..
I alla fall bör omedelbar läkarvård sökas (säkerhetsdatablad litiumklorid, 2013).
Applikationer
Litiumklorid är den förening som används för att framställa litiummetall genom elektrolys. Litiummetall framställs genom elektrolys av en smält blandning av litium och kaliumklorider.
Blandningens nedre smältpunkt (400-420 ° C eller 750-790 ° F) jämfört med ren litiumklorid (610 ° C eller 1130 ° F) möjliggör drift vid lägre temperatur av elektrolysen.
Eftersom spänningen vid vilken sönderdelning av litiumklorid sker är lägre än för kaliumklorid avsätts litium vid en renhetsnivå som är större än 97 procent (Dye, 2017).
Flytande litiumklorid fungerar som ett torkmedel som kan minska fuktighetsnivån i den omgivande luften med upp till 15 procent.
Flytande torkmedel som kombinerar litiumklorid och kalciumklorid skapar ett ämne som är billigare än litiumklorid, men mer stabilt än kalciumklorid..
Litiumklorid kyler luften snabbt eftersom kemikalien innehåller en enorm mängd vatten för sin vikt som ett fast ämne. Ämnet torkar också stora mängder industrigaser.
Litiumklorid är ett rött färgämne i pyrotekniska utställningar som fyrverkerier. Litiumklorid, eller något vattenlösligt litiumbaserat salt, brinner rött när det slås på.
Särskilda pyrotekniska effekter kan antändas genom att joniska salter blandas med brandfarliga vätskor såsom metylalkohol..
På 1940-talet fungerade litiumklorid som en ersättning för bordssalt, men vissa patienter dog av toxiska nivåer av litium..
Föreningen har farmakologiska tillämpningar som antimaniaker, vilka är medel som används för att behandla bipolära störningar eller mani associerade med andra affektiva störningar..
Människokroppen innehåller normalt cirka 7 milligram litium vid varje given tidpunkt..
Litium förekommer naturligt i växter eftersom organismer använder ämnet för att stimulera tillväxt.
Referenser
- Dye, J. L. (2017, 23 januari). Litium (Li). Återställd från britannica: britannica.com.
- EMBL-EBI. (2009, 23 november). litiumklorid. Återställd från ChEBI: ebi.ac.uk.
- LITIUMKLORID. (S.F.). Återställd från CAMEO: cameochemicals.noaa.gov.
- Säkerhetsdatablad Litiumklorid. (2013, 21 maj). Återställd från sciencelab.com.
- Nationellt centrum för bioteknikinformation ... (2005, 26 mars). PubChem Compound Database; CID = 433294. Hämtad från PubChem.
- National Institute for Occupational Safety and Health. (2015, 22 juli). LITIUMKLORID. Återställd från cdc.gov.
- Winter, M. (S.F.). Litium: litiumklorid. Återställd från webbelement.



Ingen har kommenterat den här artikeln än.