
Kvaternära föreningars egenskaper, bildning, exempel
De kvartära föreningar De är alla de som har fyra olika atomer eller joner. Därför kan de vara molekylära eller joniska arter. Deras mångfald inkluderar både organisk och oorganisk kemi, som är en mycket omfattande grupp; men kanske inte så mycket jämfört med binära eller ternära föreningar.
Anledningen till att deras antal är mindre beror på att de fyra atomerna eller jonerna måste hållas samman av sina kemiska affiniteter. Inte alla element är kompatibla med varandra och ännu mindre när en kvartett övervägs; plötsligt är ett par av dem mer besläktade med varandra än med det andra paret.
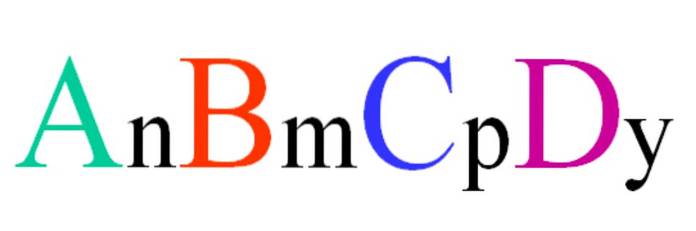
Tänk på en kvaternär förening med slumpmässig formel ABCD. Prenumerationerna n, m, p och y är de stökiometriska koefficienterna, som i sin tur indikerar hur stor andel av varje atom som finns i förhållande till de andra..
Således är formeln AnBmCsidDY det är giltigt om det överensstämmer med elektronisk neutralitet. Vidare är en sådan förening möjlig om dess fyra atomer är tillräckligt relaterade till varandra. Det kommer att framgå att denna formel inte gäller för många föreningar, men speciellt för legeringar eller mineraler..
Artikelindex
- 1 Kännetecken för kvaternära föreningar
- 1.1 Kemi
- 1.2 Fysisk
- 2 Nomenklatur
- 2.1 Sura oxisales
- 2.2 Grundläggande oxisales
- 2.3 Dubbelsalter
- 2.4 Hydrerade salter
- 3 Utbildning
- 4 Exempel
- 5 Referenser
Karaktäristika för kvaternära föreningar
Kemisk
En kvaternär förening kan vara jonisk eller kovalent och uppvisa de egenskaper som förväntas för dess natur. Joniska ABCD-föreningar förväntas vara lösliga i vatten, alkoholer eller andra polära lösningsmedel; de borde ha höga kokpunkter och smältpunkter och vara bra ledare av elektricitet när de smälts.
När det gäller de kovalenta ABCD-föreningarna består de flesta av kvävehaltiga, syresatta eller halogenerade organiska föreningar; det vill säga dess formel skulle bli CnHmELLERsidNY eller CnHmELLERsidXY, där X är en halogenatom. Av dessa molekyler skulle det vara logiskt att tro att de var polära, med tanke på de höga elektronegativiteterna O, N och X.
En rent kovalent ABCD-förening kan ha många bindningsmöjligheter: A-B, B-C, D-A, etc., uppenbarligen beroende på atomernas affiniteter och elektroniska kapacitet. Medan i en ren jonisk ABCD-förening är dess interaktioner elektrostatiska: A+B-C+D-, till exempel.
När det gäller en legering, som anses vara en fast blandning än en förening korrekt, ABCD består av neutrala atomer i marktillstånd (i teorin).
Av resten kan en ABCD-förening vara neutral, sur eller basisk, beroende på dess atomer..
Fysisk
Fysiskt sett är det troligt att ABCD inte kommer att bli en gas, eftersom fyra olika atomer alltid innebär en högre molekylmassa eller formel. Om det inte är en vätska med hög kokpunkt, kan det förväntas att det är ett fast ämne vars nedbrytning måste generera många produkter.
Återigen kommer deras färger, lukt, konsistens, kristaller etc. att vara föremål för hur A, B, C och D samexisterar i föreningen och beror på deras synergi och strukturer..
Nomenklatur
Hittills har frågan om kvaternära föreningar behandlats på ett globalt och oprecist sätt. Bortsett från organisk kemi (amider, bensylklorider, kvartära ammoniumsalter etc.) finns det i oorganisk kemi väldefinierade exempel som kallas sura och basiska oxisalt..
Syra oxisales
Syraoxisalter är sådana som härrör från partiell neutralisering av en polyprotisk oxosyra. Således ersätts en eller flera av dess väten med metallkatjoner, och ju färre kvarvarande väten den har, desto mindre sur blir den..
Till exempel från fosforsyra, H3PO4, Upp till två syrasalter av exempelvis natrium kan erhållas. Dessa är: NaHtvåPO4 (Na+ ersätter en väteekvivalent med H+och NatvåHPO4.
Enligt traditionell nomenklatur namnges dessa salter på samma sätt som oxysalter (helt deprotonerade), men med ordet "syra" före metallens namn. Således NaHtvåPO4 skulle vara natriumsyrafosfat och NatvåHPO4 natriumsyrafosfat (eftersom det har en H kvar).
Å andra sidan föredrar beståndsnomenklaturen att använda ordet "väte" än "syra". NaHtvåPO4 skulle sedan bli natriumdivätefosfat och NatvåHPO4 natriumvätefosfat. Observera att dessa salter har fyra atomer: Na, H, P och O.
Grundläggande oxisales
De grundläggande oxisaltema är de som innehåller OH-anjonen i sin sammansättning-. Tänk till exempel på saltet CaNO3OH (Catvå+ INTE3- Åh-). För att namnge det skulle det vara tillräckligt att föregå ordet "grundläggande" till namnet på metallen. Således skulle dess namn vara: basiskt kalciumnitrat. Och vad sägs om CuIO?3ÅH? Dess namn skulle vara: cupric basic jodate (Cutvå+ IO3- Åh-).
Enligt stamnomenklaturen ersätts ordet "grundläggande" med hydroxid, följt av användning av bindestreck före namnet på oxoanionen..
Upprepa de föregående exemplen, deras namn skulle vara för var och en: Kalciumhydroxid-nitrat och koppar (II) hydroxid-jodat; komma ihåg att metallens valens måste anges inom parentes och med romerska siffror.
Dubbla salter
I dubbelsalter finns det två olika katjoner som interagerar med samma typ av anjon. Anta dubbelsalt: Cu3Tro (PO4)3 (Cutvå+ Tro3+ PO43-). Det är ett fosfat av järn och koppar, men det mest lämpliga namnet att hänvisa till detta är: trippelfosfat av koppar (II) och järn (III).
Hydrerade salter
Dessa är hydrater, och den enda skillnaden är att antalet vatten som ska formuleras anges i slutet av deras namn. Till exempel MnCltvå är mangan (II) klorid.
Dess hydrat, MnCltvå4HtvåEller det kallas mangan (II) kloridtetrahydrat. Observera att det finns fyra olika atomer: Mn, Cl, H och O.
Ett känt dubbelhydrerat salt är Mohr's, Fe (NH4)två(SW4)två6HtvåO. Dess namn är: dubbeljärn (II) sulfat och ammoniumhexahydrat.
Träning
Återigen, med fokus på oorganiska kvaternära föreningar, verkar det som om de mestadels är produkten av partiella neutraliseringar. Om dessa inträffar i närvaro av flera metalloxider är det troligt att dubbla salter kommer att uppstå; och om mediet är mycket basiskt kommer de basiska oxisaltema att fällas ut.
Och om å andra sidan vattenmolekylerna har en affinitet för metallen, kommer de att samordnas direkt med den eller med jonerna som omger den och bildar hydraterna.
På legeringssidan måste fyra olika metaller eller metalloider svetsas för att skapa kondensatorer, halvledare eller transistorer..
Exempel
Slutligen visas nedan en lista med olika exempel på kvartära föreningar. Läsaren kan använda den för att testa sin kunskap om nomenklatur:
- PbCO3(ÅH)två
- Cr (HSO4)3
- NaHCO3
- ZnIOH
- Cutvå(ÅH)tvåSW3
- LitvåKAsO4
- KURS45HtvåELLER
- AgAu (SO4)två
- Fall42HtvåELLER
- FeCl36HtvåELLER
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan). CENGAGE Learning.
- Nomenklatur och oorganisk formulering. [PDF]. Återställd från: recursostic.educacion.es
- Erika Thalîa Bra. (2019). Dubbla salter. Akademi. Återställd från: academia.edu
- Wikipedia. (2019). Kvaternär ammoniumkatjon. Återställd från: en.wikipedia.org



Ingen har kommenterat den här artikeln än.