
Darmstadtium upptäckt, struktur, egenskaper, användningsområden

De darmstadtium Det är ett extremt tungt kemiskt element som ligger i transaktinidserien, som börjar strax efter Lawrence-metallen. Det ligger specifikt i grupp 10 och period 7 i det periodiska systemet, som är kongener av metallerna nickel, palladium och platina.
Dess kemiska symbol är Ds, med ett atomnummer 110, och dess mycket få atomer som har syntetiserats sönderdelas praktiskt taget direkt. Det är därför ett flyktigt element. Syntetisering och upptäckt av det representerade en bedrift på 1990-talet, med en grupp tyska forskare som tog kredit för sin upptäckt..

Innan dess upptäckt och vad dess namn skulle debatteras hade IUPAC-nomenklatursystemet formellt kallat det "ununilio", vilket betyder "en-en-noll", lika med 110. Och längre tillbaka från denna nomenklatur, enligt Mendeleev-systemet, dess namn var eka-platina eftersom det anses kemiskt analogt med denna metall.
Darmstadtium är ett element inte bara kortvarigt och instabilt utan också mycket radioaktivt, i vars kärnkraftsförfall de flesta av dess isotoper frigör alfapartiklar; dessa är nakna heliumkärnor.
På grund av dess flyktiga livslängd uppskattas alla dess egenskaper och den kan aldrig användas för något särskilt syfte..
Artikelindex
- 1 Upptäckt
- 1.1 Tysk förtjänst
- 1.2 Syntes
- 2 Darmstadtiums struktur
- 3 fastigheter
- 4 användningsområden
- 5 Referenser
Upptäckt
Tysk förtjänst
Problemet kring upptäckten av darmstadtium var att flera forskargrupper hade ägnat sig åt dess syntes under flera år. Så snart dess atom bildades försvann den i bestrålade partiklar.
Därför var det inte möjligt att fumla vem av lagen som förtjänade äran för att ha syntetiserat det först, när till och med upptäcka att det redan var en utmaning, förfalla så snabbt och släppa radioaktiva produkter..
I syntesen av darmstadtium arbetade team från följande forskningscentra separat: Central Institute for Nuclear Research i Dubná (då Sovjetunionen), Lawrence Berkeley National Laboratory (USA) och Heavy Ion Research Center (förkortat på tyska som GSI).
GSI ligger i den tyska staden Darmstadt, där de i november 1994 syntetiserade den radioaktiva isotopen 269Ds. De andra lagen syntetiserade andra isotoper: 267Ds i ICIN och 273Ds i LNLB; deras resultat hade dock inte varit avgörande i IUPAC: s kritiska ögon.
Varje lag hade föreslagit ett särskilt namn för detta nya element: hahnio (ICIN) och becquerel (LNLB). Men efter en IUPAC-rapport 2001 hade det tyska GSI-laget rätt att namnge elementet darmstadtium..
Syntes
Darmstadtium är produkten av fusion av metallatomer. Som? I princip en relativt tung som fungerar som ett mål eller mål, och en annan lätt som kommer att bringas att kollidera med den första med en hastighet som är lika med en tiondel av ljusets hastighet i vakuum; annars kunde de avstötningar som existerade mellan dess två kärnor inte övervinnas.
När de två kärnorna kolliderar effektivt kommer en kärnfusionsreaktion att inträffa. Protonerna lägger till, men neutronernas öde är annorlunda. Till exempel utvecklade GSI följande kärnreaktion, av vilken den första atomen producerades 269Ds:
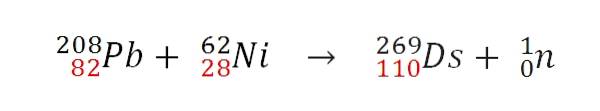
Observera att protonerna (i rött) lägger till. Genom att variera atommassorna hos de kolliderande atomerna erhålls olika isotoper av darmstadtium. Faktum är att GSI genomförde experiment med isotopen 64Inte i stället för 62Ni, varav endast 9 atomer i isotopen syntetiserades 271Ds.
GSI lyckades skapa 3 atomer av 269Ds, men efter att ha utfört tre biljoner bombardemang per sekund under en hel vecka. Dessa data ger ett överväldigande perspektiv på dimensionerna hos sådana experiment..
Struktur av darmstadtium
Eftersom endast en darmstadtiumatom kan syntetiseras eller skapas per vecka är det osannolikt att det finns tillräckligt med dem för att skapa en kristall; för att inte tala om att den mest stabila isotopen är 281Gud, vars t1/2 det tar bara 12,7 sekunder.
För att bestämma dess kristallina struktur bygger forskare därför på beräkningar och uppskattningar som försöker komma närmare den mest realistiska bilden. Således har strukturen för darmstadtium uppskattats vara kroppscentrerad kubisk (bcc); till skillnad från deras lättare kongener nickel, palladium och platina, med ansiktscentrerade kubiska (fcc) strukturer.
I teorin måste de yttersta elektronerna i 6d- och 7s-orbitalerna delta i deras metallbindning, enligt deras också uppskattade elektroniska konfiguration:
[Rn] 5f146d87stvå
Emellertid är det troligt att lite är känt experimentellt om de fysiska egenskaperna hos denna metall..
Egenskaper

De andra egenskaperna hos darmstadtium uppskattas också av samma skäl som nämnts för dess struktur. Några av dessa uppskattningar är dock intressanta. Till exempel skulle darmstadtium vara en ännu mer ädel metall än guld, såväl som mycket tätare (34,8 g / cm3) än osmium (22,59 g / cm ^)3) och kvicksilver (13,6 g / cm ^)3).
Beträffande dess möjliga oxidationstillstånd har det uppskattats att de skulle vara +6 (Ds6+), +4 (Ds4+) och +2 (Dstvå+), lika med de av deras lättare kongener. Därför, om atomerna i 281Ds innan de sönderfaller, skulle föreningar såsom DsF erhållas6 eller DsCl4.
Överraskande finns det en sannolikhet för att syntetisera dessa föreningar, eftersom 12,7 sekunder, den t1/2 av 281Gud, det här är mer än tillräckligt med tid för att utföra reaktionerna. Nackdelen fortsätter dock att vara att bara en Ds-atom per vecka är otillräcklig för att samla in alla data som krävs för statistisk analys..
Applikationer
Återigen, eftersom det är en sådan sällsynt metall, för närvarande syntetiserad i atom- och icke-massiva mängder, finns det ingen användning reserverad för den; inte ens i en avlägsen framtid.
Om inte en metod uppfinns för att stabilisera deras radioaktiva isotoper, kommer darmstadtiumatomer endast att väcka vetenskaplig nyfikenhet, särskilt när det gäller kärnfysik och kemi..
Men om du räknar ut något sätt att skapa dem i stora mängder kommer mer ljus att kastas på kemin i detta ultratunga och kortlivade element..
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Wikipedia. (2020). Darmstadtium. Återställd från: en.wikipedia.org
- Steve Gagnon. (s.f.). Elementet Darmstadtium. Jefferson Lab-resurser. Återställd från: education.jlab.org
- Nationellt centrum för bioteknikinformation. (2020). Darmstadtium. PubChem-databas. Återställd från: pubchem.ncbi.nlm.nih.gov
- Brian Clegg. (15 december 2019). Darmstadtium. Kemi i dess element. Återställd från: chemistryworld.com



Ingen har kommenterat den här artikeln än.