
Moeller-diagram över vad det består och övningar löst
De Moeller-diagram o Rain-metoden är en grafisk och mnemonisk metod för att lära sig Madelungs regel; det vill säga hur man skriver elektronkonfigurationen för ett element. Det kännetecknas av att rita diagonaler genom orbitalernas kolumner, och efter pilens riktning fastställs rätt ordning på samma för en atom.
I vissa delar av världen är Moeller-diagrammet också känt som regnmetod. Genom detta definieras en ordning i fyllningen av orbitalerna, som också definieras av de tre kvantnummer n, l Y ml.
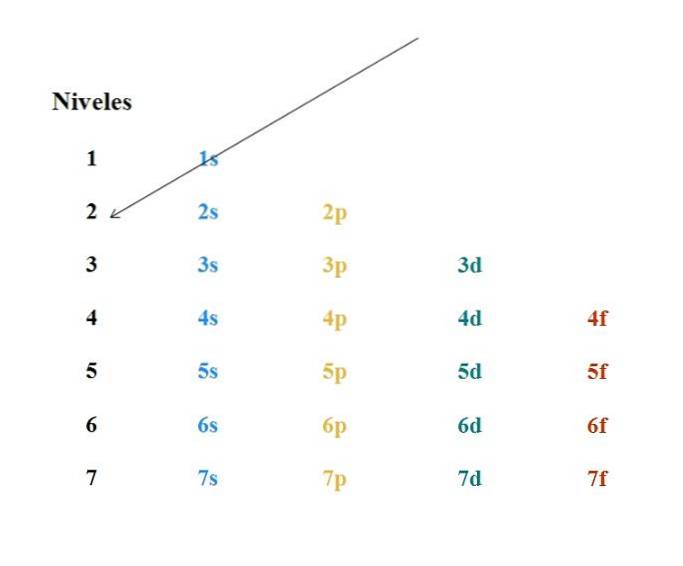
Ett enkelt Moeller-diagram visas i bilden ovan. Varje kolumn motsvarar olika orbitaler: s, p, d och f, med sina respektive energinivåer. Den första pilen indikerar att fyllningen av en atom måste börja med 1s-omloppet.
Således måste nästa pil börja från 2s-banan och sedan från 2p till 3s-banan. På detta sätt, som om det vore ett regn, orbitalerna och antalet elektroner de innehåller (4l+två).
Moeller-diagrammet representerar en introduktion för dem som studerar elektronkonfigurationer..
Artikelindex
- 1 Vad är Moeller-diagrammet?
- 1.1 Madelungs regel
- 1.2 Steg att följa
- 2 Lösta övningar
- 2.1 Beryllium
- 2.2 Fosfor
- 2.3 Zirkonium
- 2.4 Iridium
- 2.5 Undantag från Moeller-diagrammet och Madelungs regel
- 3 Referenser
Vad är Moeller-diagrammet?
Madelungs styre
Eftersom Moeller-diagrammet består av en grafisk representation av Madelungs regel är det nödvändigt att veta hur den senare fungerar. Fyllningen av orbitalerna måste följa följande två regler:
-Orbitalerna med de lägsta värdena på n+l fylls först, är n huvudkvantantalet och l omloppsvinkelmomentet. Till exempel motsvarar 3d-banan n= 3 och l= 2, därför, n+l= 3 + 2 = 5; under tiden motsvarar 4-banan n= 4 och l= 0 och n+l= 4 + 0 = 4. Av ovanstående är det fastställt att elektronerna fyller 4s-banan först än den 3d.
-Om två orbitaler har samma värde på n+l, elektronerna kommer att uppta först den med det lägsta värdet på n. Till exempel har 3d-banan ett värde på n+l= 5, som 4p-banan (4 + 1 = 5); men eftersom 3d har det minsta värdet på n, fylls tidigare än 4p.
Från de två tidigare observationerna kan följande ordning för fyllning av orbitalerna nås: 1s 2s 2p 3s 3p 4s 3d 4p.
Följande steg för olika värden på n+l för varje omlopp erhålls de elektroniska konfigurationerna för andra atomer; vilket i sin tur också kan bestämmas grafiskt av Moeller-diagrammet.
Steg att följa
Madelungs regel anger formeln n+l, med vilken den elektroniska konfigurationen kan "beväpnas". Men som nämnts representerar Moeller-diagrammet grafiskt detta; så följ bara dess kolumner och rita diagonaler steg för steg.
Hur startar du då den elektroniska konfigurationen av en atom? För att göra detta måste du först veta dess atomnummer Z, som per definition för en neutral atom är lika med antalet elektroner.
Med Z erhålls således antalet elektroner, och med detta i åtanke börjar vi rita diagonaler genom Moeller-diagrammet.
Orbitalerna kan rymma två elektroner (tillämpa formeln 4l+2), p sex elektroner, d tio och f fjorton. Det stannar vid omloppsbana där den sista elektronen som Z gett har varit upptagen.
För ytterligare förtydligande, nedan finns en serie lösta övningar.
Lösta övningar
Beryllium
Med hjälp av det periodiska systemet är elementet beryllium beläget med en Z = 4; det vill säga dess fyra elektroner måste rymmas i orbitalerna.
Från och med den första pilen i Moeller-diagrammet upptar 1s-banan två elektroner: 1stvå; följt av 2s orbital, med ytterligare två elektroner för att lägga till upp till totalt 4: 2stvå.
Därför är berilliumens elektronkonfiguration, uttryckt som [Be] 1stvå2stvå. Observera att summeringen av överskrifterna är lika med antalet totala elektroner.
Match
Elementet fosfor har en Z = 15, och därför har den totalt 15 elektroner som måste uppta orbitalerna. För att gå vidare börjar du omedelbart med 1s-inställningentvå2stvå, som innehåller 4 elektroner. Då skulle ytterligare 9 elektroner saknas.
Efter 2s-banan "kommer" nästa pil genom 2p-banan och landar slutligen i 3s-banan. Eftersom 2p-orbitalerna kan uppta 6 elektroner och 3s 2-elektroner har vi: 1stvå2stvå2 s63stvå.
Det saknas fortfarande 3 elektroner till, som upptar följande 3p-omlopp enligt Moeller-diagrammet: 1stvå2stvå2 s63stvå3p3, elektronkonfiguration av fosfor [P].
Zirkonium
Elementet zirkonium har en Z = 40. Förkortningsväg med 1s inställningtvå2stvå2 s63stvå3p6, med 18 elektroner (den hos ädelgasargonen) skulle 22 andra elektroner saknas. Efter 3p-banan är nästa som fylls enligt Moeller-diagrammet 4s, 3d, 4p och 5s orbitaler.
Fylla dem helt, det vill säga 4stvå, 3d10, 4p6 och 5stvå, totalt 20 elektroner läggs till. De två återstående elektronerna är därför inrymda i följande omlopp: 4d. Sålunda är elektronkonfigurationen för zirkonium, [Zr]: 1stvå2stvå2 s63stvå3p64stvå3d104p65stvå4dtvå.
Iridium
Iridium har Z = 77, så det har 37 ytterligare elektroner jämfört med zirkonium. Från och med [Cd], det vill säga 1stvå2stvå2 s63stvå3p64stvå3d104p65stvå4d10, lägg till 29 elektroner med följande orbitaler i Moeller-diagrammet.
Rita nya diagonaler, de nya orbitalerna är: 5p, 6s, 4f och 5d. Att fylla de första tre orbitalerna helt har vi: 5p6, 6stvå och 4f14, för att ge totalt 22 elektroner.
Så 7 elektroner saknas, som befinner sig i 5d: 1s omlopp.två2stvå2 s63stvå3p64stvå3d104p65stvå4d105 s66stvå4f145 d7.
Ovanstående är elektronkonfigurationen för iridium, [Go]. Observera att 6-talets orbitalertvå och 5d7 är markerade med fet stil för att indikera att de motsvarar korrekt valensskiktet på denna metall.
Undantag från Moeller-diagrammet och Madelungs regel
Det finns många element i det periodiska systemet som inte följer det som just har förklarats. Deras elektronkonfigurationer skiljer sig experimentellt från de som förutspås av kvantskäl..
Bland de element som presenterar dessa avvikelser är: krom (Z = 24), koppar (Z = 29), silver (Z = 47), rodium (Z = 45), cerium (Z = 58), niob (Z = 41) och många fler.
Undantag är mycket frekventa vid fyllningen av d- och f-orbitalerna. Till exempel bör krom ha en valensinställning på 4stvå3d4 enligt Moellers diagram och Madelungs regel, men det är faktiskt 4s13d5.
Och slutligen bör silvervalensinställningen vara 5stvå4d9; men det är verkligen 5s14d10.
Referenser
- Gavira J. Vallejo M. (6 augusti 2013). Undantag från Madelungs regel och Mellers diagram i den elektroniska konfigurationen av kemiska element. Återställd från: triplenlace.com
- Min superklass. (s.f.) Vad är elektronkonfiguration? Återställd från: misuperclase.com
- Wikipedia. (2018). Moeller-diagram. Återställd från: es.wikipedia.org
- Dummies. (2018). Hur man representerar elektroner i ett energinivådiagram. Återställd från: dummies.com
- Nave R. (2016). Beställning av fyllning av elektronstater. Återställd från: hyperphysics.phy-astr.gsu.edu



<a href=http://slkjfdf.net/>Unasofi</a> <a href="http://slkjfdf.net/">Donyufu</a> rih.cplf.sv.pokemongoplanet.com.deh.zo http://slkjfdf.net/