
Diklormetanstruktur, egenskaper, användningsområden, toxicitet
De diklormetan, även känd som metylenklorid, det är en organisk förening vars kemiska formel är CHtvåCltvå. Specifikt är det en alkylhalogenid härledd från metangas. Till skillnad från metan är denna förening en färglös, polär vätska.
Det syntetiserades ursprungligen 1839 av den franska kemisten och fysikern Henri Victor Regnault (1810-1878), som lyckades isolera den från en blandning av klor och klormetan utsatt för solljus..

Diklormetan produceras industriellt genom att behandla metan eller klormetan med klorgas vid förhöjda temperaturer (400-500 ºC). Tillsammans med diklormetan produceras kloroform och koltetraklorid i processen som separeras genom destillation..
Diklormetan används som lösningsmedel som möjliggör svetsning av plastmaterial och avfettning av metaller. Det används också vid koffeinfri kaffe och te, liksom en humlextraktor och utspädningsmedel för färgtillsatser och bläck för att markera frukt..
Diklormetan är en giftig förening som kan orsaka irritation i näspassage och hals genom inandning. Leverskador har rapporterats hos arbetare som utsätts för höga koncentrationer av diklormetan. Dessutom är det ett mutagent medel som misstänks vara cancerframkallande.
Artikelindex
- 1 Struktur
- 2 fastigheter
- 2.1 Utseende
- 2.2 Molmassa
- 2.3 Lukt
- 2.4 Lukttröskel
- 2.5 Densitet
- 2.6 Smältpunkt
- 2.7 Kokpunkt
- 2.8 Löslighet i vatten
- 2.9 Löslighet i andra lösningsmedel
- 2.10 Fördelningskoefficient oktanol / vatten
- 2.11 Ångtryck
- 2.12 Ångdensitet
- 2.13 Brytningsindex (πD)
- 2.14 Viskositet
- 2.15 Flampunkt
- 2.16 Självantändningstemperatur
- 2.17 Stabilitet
- 2.18 Sönderfall
- 2.19 Korrosion
- 2.20 Förångningsvärme
- 2.21 Ytspänning
- 2.22 Reaktivitet
- 3 användningsområden
- 3.1 Livsmedelsbearbetning
- 3.2 Läkemedelsindustrin
- 3.3 Fotografering
- 3.4 Elektronikindustrin
- 3.5 Målningar
- 3.6 Transport
- 3.7 Andra användningsområden
- 4 Toxicitet
- 4.1 Akuta effekter
- 4.2 Kroniska effekter
- 5 Referenser
Strukturera
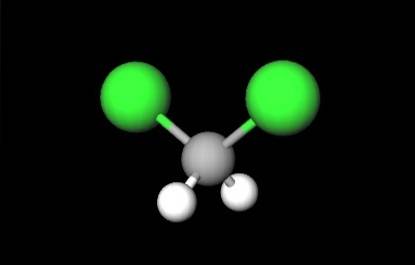
Den första bilden visade strukturformeln för CHtvåCltvå, i vilken deras kovalenta bindningar C-H och C-Cl sticker ut. Ovanför dess har dess struktur representerad av en modell av sfärer och stänger. Lägg märke till med blotta ögat att C-H-bindningarna (vita sfärer) är korta, medan C-Cl-bindningarna (gröna sfärer) är långa.
CH-geometrintvåCltvå det är tetraeder; men förvrängd av de större kloratomerna. En ände av tetraedern definieras av de två kloratomerna, mer elektronegativa än de för väte och kol. Därför i CH-molekylentvåCltvå ett permanent dipolmoment upprättas (1.6D).
Detta gör att diklormetanmolekylerna kan interagera med varandra genom dipol-dipolkrafter. På samma sätt är dessa intermolekylära interaktioner ansvariga för det faktum att denna förening existerar som en vätska trots dess låga molekylvikt; en vätska som emellertid är ganska flyktig.
Egenskaper
Utseende
Färglös vätska.
Molmassa
84,93 g / mol.
Odör
Söt, liknar kloroform.
Lukttröskel
205 - 307 ppm.
Densitet
1,3266 g / cm3 (20 ºC).
Smältpunkt
- 97,6 ºC.
Kokpunkt
39,6 ºC.
Vattenlöslighet
25,6 g / L vid 15 ° C och 5,2 g / L vid 60 ° C.
Diklormetan är knappt lösligt i vatten. Medan båda molekylerna, CHtvåCltvå och HtvåEller, de är polära, deras interaktioner är ineffektiva, möjligen på grund av avstötningen mellan klor- och syreatomerna.
Löslighet i andra lösningsmedel
Blandbart med etylacetat, alkohol, hexan, bensen, koltetraklorid, dietyleter, kloroform och dimetylformamid.
Fördelningskoefficient oktanol / vatten
Logg P = 1,19.
Ångtryck
57,3 kPa (25 ° C). Detta tryck motsvarar ungefär 5,66 atm, vilket återspeglar ett högt ångtryck..
Ång-densitet
2,93 i förhållande till luft tagen som 1.
Brytningsindex (πD)
1.4244 (20 ºC).
Viskositet
0,413 cP (25 ° C).
antändningspunkt
Diklormetan är inte brandfarligt, men när det blandas med luft bildar det brandfarliga ångor över 100 ° C..
Självantändningstemperatur
556 ºC.
Stabilitet
Den är stabil vid omgivningstemperatur i frånvaro av fukt, och har en relativ stabilitet jämfört med dess kongener: kloroform och koltetraklorid..
Det tenderar att kola vid höga temperaturer (300-450 ºC), när ångorna kommer i kontakt med stål och metallklorider.
Sönderfall
Kan sönderdelas vid kontakt med heta ytor eller låga och avge giftiga och irriterande ångor av fosgen och klorväte..
Korrosion
Diklormetan angriper vissa former av plast, gummi och beläggningar.
Förångningsvärme
28,82 kJ / mol vid 25 ºC.
Ytspänning
28,20 dyn / cm vid 25 ºC.
Reaktivitet
Diklormetan reagerar starkt med aktiva metaller, såsom kalium, natrium och litium. Reagerar med starka baser, t.ex. kalium-tert-butoxid. Det är oförenligt med frätande ämnen, oxidanter och kemiskt aktiva metaller.
Dessutom reagerar det med flytande syre i natrium- och kaliumlegeringar och kvävetetroxid. Vid kontakt med vatten kan det korrodera vissa rostfria stål, nickel, koppar och järn.
Applikationer
De flesta användningarna och tillämpningarna av diklormetan är baserade på dess egenskaper som lösningsmedel. På grund av denna egenskap används diklormetan i livsmedels-, transport-, medicinproduktionsindustrin etc..
Livsmedelsbearbetning
Diklormetan används vid koffeinfrihet av kaffebönor och teblad. Det används också för utvinning av humle för öl, drycker och andra smakämnen för mat, liksom för bearbetning av kryddor..
Läkemedelsindustri
Diklormetan används för framställning av cefalosporin och ampicillin, förutom tillverkningen av antibiotika, steroider och vitaminer.
Fotografi
Det används också som lösningsmedel vid produktion av cellulosatriacetat (CTA), som används vid skapandet av säkerhetsfilmer.
Elektronisk industri
Det är en idealisk förening för produktion av tryckta kretskort, som används för att avfetta aluminiumytan innan du lägger till fotoresistskiktet på kortet..
Målar
Diklormetan är ett lösningsmedel som finns i lacker och färgavskiljare, som används för att ta bort lack eller färgbeläggning från olika typer av ytor..
Transport
Den används för att avfetta metalldelar och ytor som finns i järnvägsutrustning såväl som i flygplanskomponenter.
Andra användningsområden
Det används som spraydrivmedel (aerosoler) och som ett jäsmedel för polyuretanskum. Det används också som vätska i vissa typer av julbelysning.
Giftighet
Akuta effekter
Inandning av diklormetan kan orsaka irritation i de övre luftvägarna, hosta, väsande andning eller andfåddhet..
Det kan orsaka rodnad i huden, och om föreningen förblir på den under lång tid kan det orsaka kemiska brännskador. Vid kontakt med ögonen ger diklormetan en allvarlig irritation som kan sträcka sig till en brännskada.
Dessutom fungerar det som ett neurotoxin som genererar syn-, hörsel- och psykomotoriska störningar. men dessa effekter är reversibla när inandning av diklormetan stoppas.
Kroniska effekter
Diklormetan kan påverka centrala nervsystemet och orsaka huvudvärk, mental förvirring, illamående, kräkningar och minnesförlust..
Hos djur producerar det skadliga effekter på levern, njurarna, centrala nervsystemet och hjärt-kärlsystemet.
När det gäller cancerframkallande har ingen signifikant ökning av cancerdöd rapporterats hos arbetare som exponerats för diklormetan. Djurstudier har dock visat en ökning hänförlig till diklormetan i förekomsten av lever- och lungcancer, liksom godartade tumörer i bröstkörtlarna..
Referenser
- Morrison, R. T. och Boyd, R, N. (1987). Organisk kemi. 5ta Utgåva. Ledare Addison-Wesley Interamericana.
- Carey F. (2008). Organisk kemi. (Sjätte upplagan). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. (10th utgåva.). Wiley plus.
- Nationellt centrum för bioteknikinformation. (2020). Diklormetan. PubChem-databas., CID = 6344. Återställd från: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2020). Diklormetan. Återställd från: en.wikipedia.org
- Brumer. (14 juli 2018). Diklormetan. Återställd från: brumer.com
- MSDS Online. (2019). Diklormetan (metylenklorid) Faror och säkerhetsinformation. Återställd från: msdsonline.com
- EPA. (2000). Metylenklorid (diklormetan). [PDF]. Återställd från: epa.gov



Ingen har kommenterat den här artikeln än.