
Kemiska bindningsegenskaper, hur de bildas, typer
De Kemisk bindning det är kraften som lyckas hålla samman atomerna som utgör materien. Varje typ av materia har en karakteristisk kemisk bindning, som består av deltagande av en eller flera elektroner. Således är krafterna som förenar atomer i gaser olika, till exempel från metaller.
Alla element i det periodiska systemet (med undantag av helium och de lätta ädelgaserna) kan bilda kemiska bindningar med varandra. Emellertid ändras arten av dessa beroende på vilka element elektronerna som bildar dem kommer från. En viktig parameter för att förklara typen av obligationer är elektronegativitet.
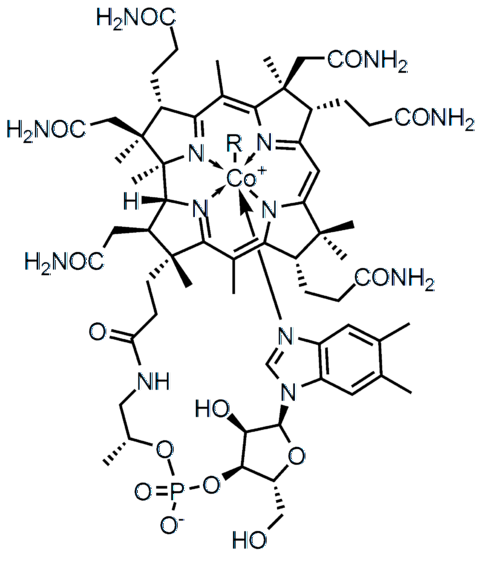
Skillnaden i elektronegativitet (AE) mellan två atomer definierar inte bara typen av kemisk bindning utan också föreningens fysikalisk-kemiska egenskaper. Salterna kännetecknas av att de har jonbindningar (hög AE) och många av de organiska föreningarna, såsom vitamin B12 (översta bilden), kovalenta bindningar (ΔE låg).
I den högre molekylära strukturen representerar var och en av linjerna en kovalent bindning. Kilarna indikerar att länken kommer ut från planet (mot läsaren) och de understrukna bakom planet (bort från läsaren). Observera att det finns dubbelbindningar (=) och en koboltatom samordnas med fem kväveatomer och en R-sidokedja.
Men varför bildas sådana kemiska bindningar? Svaret ligger i den energiska stabiliteten hos de deltagande atomerna och elektronerna. Denna stabilitet måste balansera de elektrostatiska avstötningarna som upplevs mellan elektronmoln och kärnor och den attraktion som en kärna utövar på elektronerna i den angränsande atomen..
Artikelindex
- 1 Definition av kemisk bindning
- 2 funktioner
- 3 Hur bildas kemiska bindningar?
- 3.1 Homonukleära föreningar A-A
- 3.2 Heteronukleära föreningar A-B
- 4 Typer av kemiska bindningar
- 4.1 -Kovalent bindning
- 4,2-jonisk bindning
- 4.3 Metallbindning
- 5 Exempel på länkar
- 6 Betydelsen av den kemiska bindningen
- 7 Referenser
Definition av kemisk bindning
Många författare har gett definitioner av den kemiska bindningen. Av alla dessa var det viktigaste fysikokemisten G. N. Lewis, som definierade den kemiska bindningen som deltagande av ett par elektroner mellan två atomer. Om atomerna A och B kan bidra med en enda elektron, bildas enkelbindningen A: B eller A-B mellan dem.
Innan bindningsbildningen separeras både A och B med ett obestämt avstånd, men vid bindning finns det nu en kraft som håller dem samman i den diatomiska föreningen AB och en bindningsavstånd (eller längd).
Egenskaper
Vilka är kännetecknen för denna kraft som håller atomerna samman? Dessa beror mer på typen av länk mellan A och B än på deras elektroniska strukturer. Till exempel är A-B-länken riktad. Vad betyder det? Att kraften som utövas av föreningen av elektronparet kan representeras på en axel (som om det vore en cylinder).
Detta band kräver också energi för att bryta. Denna mängd energi kan uttryckas i enheterna kJ / mol eller cal / mol. När tillräckligt med energi har applicerats på förening AB (till exempel genom värme) kommer den att dissocieras till de ursprungliga A- och B-atomerna..
Ju mer stabil bindningen desto mer energi krävs för att separera de bundna atomerna..
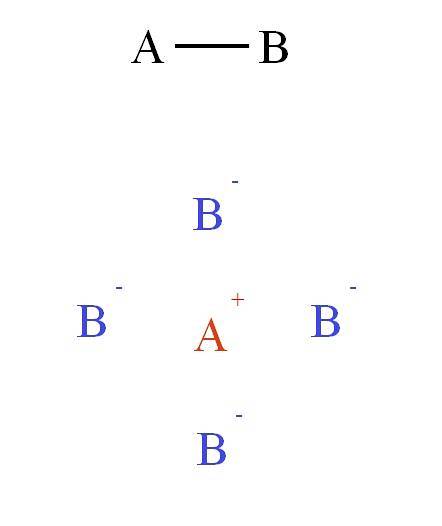
Å andra sidan, om bindningen i förening AB var jonisk, A+B-, då skulle det vara en icke-riktad kraft. Varför? Därför att+ utövar en attraktiv kraft på B- (och tvärtom) som beror mer på avståndet som skiljer båda jonerna i rymden än på deras relativa plats.
Detta fält av attraktion och avstötning samlar andra joner för att bilda det som kallas kristallgitteret (toppbild: katjon A+ ligger omgiven av fyra anjoner B-, och dessa fyra katjoner A+ och så vidare).
Hur bildas kemiska bindningar?
Homonukleära föreningar A-A
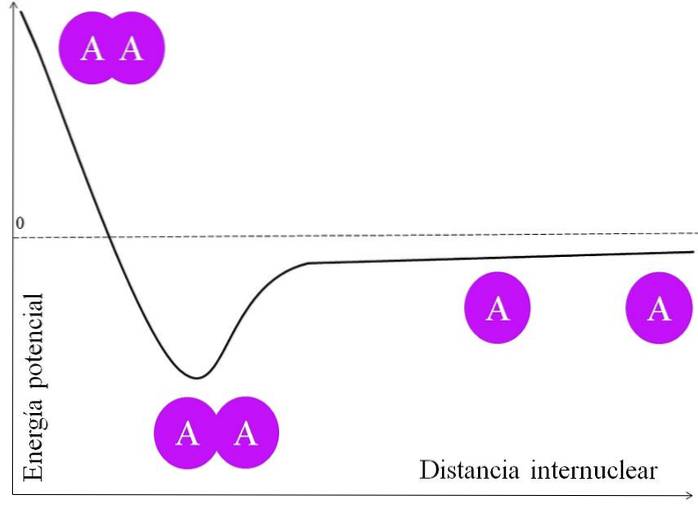
För att ett par elektroner ska bilda en bindning finns det många saker som måste övervägas först. Kärnorna, för att säga A, har protoner och är därför positiva. När två A-atomer är mycket långt ifrån varandra, det vill säga på ett stort internukleärt avstånd (övre bild), upplever de ingen attraktion.
När de två A-atomerna närmar sig sina kärnor drar de till sig elektronmolnet för den angränsande atomen (den lila cirkeln). Detta är attraktionskraften (A på den angränsande lila cirkeln). De två A-kärnorna stöter emellertid varandra eftersom de är positiva, och denna kraft ökar bindningens potentiella energi (vertikal axel).
Det finns ett kärnavstånd inom vilket den potentiella energin når ett minimum; det vill säga både de attraktiva och avstötande krafterna är balanserade (de två A-atomerna i bildens nedre del).
Om detta avstånd minskar efter denna punkt kommer bindningen att orsaka att de två kärnorna stöter ut varandra med stor kraft och destabiliserar A-A-föreningen..
Så för att bindningen ska bildas måste det finnas ett energiskt tillräckligt avstånd från kärnan; och dessutom måste atomorbitalerna överlappa korrekt för att elektronerna ska kunna bindas.
Heteronukleära föreningar A-B
Vad händer om istället för två atomer av A skulle en av A och den andra av B gå med? I detta fall skulle den övre grafen förändras eftersom en av atomerna skulle ha fler protoner än den andra, och elektronmolnen skulle ha olika storlekar..
Eftersom A-B-bindningen bildas på lämpligt internkärnavstånd, kommer elektronparet att finnas främst i närheten av den mest elektronegativa atomen. Detta är fallet med alla heteronukleära kemiska föreningar, som utgör den stora majoriteten av de som är kända (och kommer att vara kända).
Även om det inte nämns djupt finns det många variabler som direkt påverkar hur atomer närmar sig och kemiska bindningar bildas; vissa är termodynamiska (är reaktionen spontan?), elektroniska (hur fulla eller tomma är atomernas orbitaler) och andra kinetiska.
Typer av kemiska bindningar
Länkar har en rad egenskaper som skiljer dem från varandra. Flera av dem kan inramas i tre huvudklassificeringar: kovalent, joniskt eller metalliskt.
Även om det finns föreningar vars bindningar tillhör en enda typ, består många faktiskt av en blandning av tecken av varje. Detta faktum beror på skillnaden i elektronegativitet mellan atomerna som bildar bindningarna. Således kan vissa föreningar vara kovalenta, men har en viss jonisk karaktär i sina bindningar..
Likaså är typen av bindning, strukturen och molekylmassan nyckelfaktorer som definierar de makroskopiska egenskaperna hos materien (ljusstyrka, hårdhet, löslighet, smältpunkt, etc.).
-Kovalent bindning
Kovalenta bindningar är de som har förklarats hittills. I dem måste två orbitaler (en elektron i vardera) överlappa varandra med kärnorna separerade på ett lämpligt internkärnavstånd..
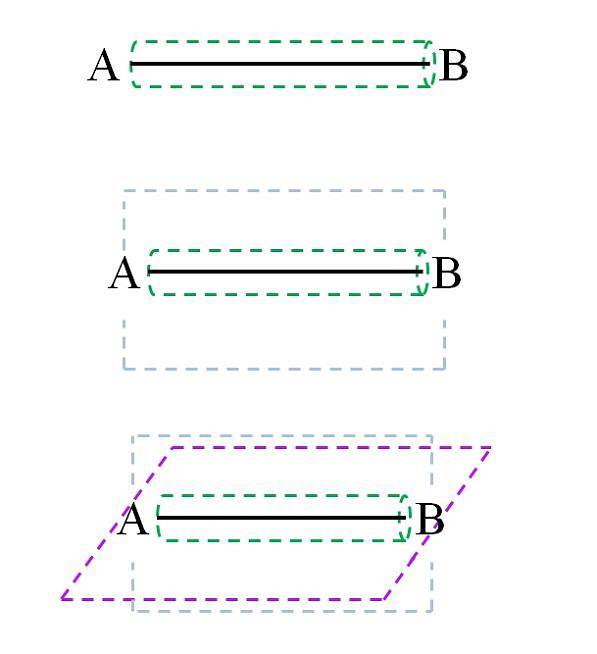
Enligt molekylär orbitalteori (TOM), om överlappningen av orbitalerna är frontal, kommer en sigma σ-bindning att bildas (vilket också kallas en enkel eller enkel bindning). Medan orbitalerna bildas av laterala och vinkelräta överlappningar i förhållande till den interkärniga axeln, kommer vi att ha π-bindningarna (dubbel och trippel):
Enkel länk
Σ-bindningen, som kan ses på bilden, bildas längs den kärnkraftiga axeln. Även om det inte visas kan A och B ha andra bindningar, och därför sina egna kemiska miljöer (olika delar av molekylstrukturen). Denna typ av länk kännetecknas av sin roterande kraft (grön cylinder) och är den starkaste av alla.
Till exempel kan den enskilda bindningen i vätemolekylen rotera på den interkärniga (H-H) axeln. På samma sätt kan en hypotetisk molekyl CA-AB göra det..
Länkar C-A, A-A och A-B roterar; men om C eller B är atomer eller en grupp skrymmande atomer hindras A-A-rotationen steriskt (eftersom C och B skulle kollidera).
Enkelbindningar finns i praktiskt taget alla molekyler. Deras atomer kan ha någon kemisk hybridisering så länge överlappningen av deras orbitaler är frontal. Återgår till strukturen av vitamin B12, vilken rad som helst (-) anger en enda länk (till exempel -CONH-länkartvå).
Dubbel länk
Dubbelbindningen kräver att atomerna har (vanligtvis) sp-hybridiseringtvå. Den rena p-bindningen, vinkelrät mot de tre hybrid-sp-orbitalernatvå, bildar dubbelbindningen, som visas som ett gråaktigt ark.
Observera att både enkelbindningen (grön cylinder) och dubbelbindningen (grått ark) existerar samtidigt. Till skillnad från enkelbindningar har dock dubbelbindningar inte samma rotationsfrihet runt den kärnkraftiga axeln. Detta beror på att länken (eller folien) måste brytas för att rotera; process som behöver energi.
Dessutom är A = B-bindningen mer reaktiv än A-B. Dess längd är kortare och atomerna A och B har ett kortare kärnavstånd; därför finns det större avstötning mellan båda kärnorna. Att bryta både enkel- och dubbelbindningarna kräver mer energi än vad som krävs för att separera atomerna i A-B-molekylen..
I strukturen av vitamin B12 flera dubbelbindningar kan observeras: C = O, P = O och inom de aromatiska ringarna.
Trippelbindning
Trippelbindningen är ännu kortare än dubbelbindningen och dess rotation hindras mer energiskt. I den bildas två vinkelräta π-bindningar (de gråaktiga och lila arken), liksom en enda bindning.
Vanligtvis måste den kemiska hybridiseringen av A- och B-atomerna vara sp: två sp-orbitaler 180 ° från varandra och två rena p-orbitaler vinkelrätt mot den första. Observera att en trippelbindning ser ut som en paddel, men utan rotationskraft. Denna bindning kan representeras helt enkelt som A ^ B (N ^ N, kvävemolekyl Ntvå).
Av alla de kovalenta bindningarna är detta den mest reaktiva; men samtidigt den som behöver mer energi för fullständig separation av dess atomer (· A: +: B ·). Om vitamin B12 hade en trippelbindning inom sin molekylstruktur, skulle dess farmakologiska effekt drastiskt förändras.
Sex elektroner deltar i trippelbindningar; i dubbel, fyra elektroner; och i det enkla eller enkla, två.
Bildandet av en eller flera av dessa kovalenta bindningar beror på atomernas elektroniska tillgänglighet; det vill säga hur många elektroner som deras orbitaler behöver för att förvärva en valentoktet.
Icke-polär bindning
En kovalent bindning består av en lika delning av ett elektronpar mellan två atomer. Men detta är strikt sant endast i fallet där båda atomerna har lika elektronegativiteter; det vill säga samma tendens att locka elektrontäthet från sin omgivning till en komposit.
Icke-polära bindningar kännetecknas av en noll elektronegativitetsskillnad (ΔE≈0). Detta inträffar i två situationer: i en homonukleär förening (Atvå), eller om de kemiska miljöerna på båda sidor av bindningen är ekvivalenta (H3C-CH3, etanmolekyl).
Exempel på icke-polära bindningar ses i följande föreningar:
-Väte (H-H)
-Syre (O = O)
-Kväve (N≡N)
-Fluor (F-F)
-Klor (Cl-Cl)
-Acetylen (HC2CH)
Polarbindningar
När det finns en markant skillnad i elektronegativitet AE mellan båda atomerna bildas ett dipolmoment längs bindningsaxeln: A5+-B5-. När det gäller den heteronukleära föreningen AB är B den mest elektronegativa atomen och därför har den en högre elektrontäthet δ-; medan A, den minst elektronegativa, laddningsbrist δ+.
För att de polära bindningarna ska kunna inträffa måste två atomer med olika elektronegativitet förenas; och bildar således heteronukleära föreningar. A-B liknar en magnet: den har en positiv och en negativ pol. Detta gör det möjligt att interagera med andra molekyler genom dipol-dipolkrafter, bland vilka finns vätebindningar..
Vatten har två polära kovalenta bindningar, H-O-H, och dess molekylgeometri är vinkel, vilket ökar dess dipolmoment. Om dess geometri var linjär skulle haven avdunsta och vattnet skulle ha en lägre kokpunkt.
Det faktum att en förening har polära bindningar, innebär inte att det är polärt. Exempelvis koltetraklorid, CCl4, har fyra polära C-Cl-bindningar, men på grund av deras tetraedriska arrangemang slutar dipolmomentet att upphävas vektorellt.
Dative- eller koordinationslänkar
När en atom ger upp ett par elektroner för att bilda en kovalent bindning med en annan atom, talar vi om en dativ- eller koordinationsbindning. Till exempel med B: det tillgängliga elektronparet och A (eller A+), en elektronisk vakans, bildas länken B: A.
I strukturen av vitamin B12 de fem kväveatomerna är bundna till Co-metallens centrum genom denna typ av kovalent bindning. Dessa kväve ger upp sitt fria elektronpar till Co-katjonen.3+, samordna metallen med dem (Co3+: N-)
Ett annat exempel kan hittas i protoneringen av en ammoniakmolekyl för att bilda ammoniak:
H3N: + H+ => NH4+
Observera att det i båda fallen är kväveatomen som bidrar med elektronerna; därför uppträder den dativa eller koordinerande kovalenta bindningen när en atom ensam bidrar med elektronparet.
På samma sätt kan vattenmolekylen protoneras för att bli hydronium (eller oxonium) katjonen:
HtvåO + H+ => H3ELLER+
Till skillnad från ammoniumkatjonen har hydronium fortfarande ett fritt elektronpar (H3ELLER:+); emellertid är det mycket svårt för det att acceptera ett annat proton för att bilda den instabila hydroniumdikationen, H4ELLERtvå+.
-Joniskt band

På bilden finns en vit saltkulle. Salterna kännetecknas av att de har kristallina strukturer, det vill säga symmetriska och ordnade; höga smältpunkter och kokpunkter, höga elektriska konduktiviteter vid smältning eller upplösning, och dess joner är starkt bundna av elektrostatiska interaktioner.
Dessa interaktioner utgör det som kallas jonbindningen. I den andra bilden visades en katjon A+ omgiven av fyra anjoner B-, men detta är en 2D-representation. I tre dimensioner, A+ borde ha andra anjoner B- framåt och bakom planet och bildar olika strukturer.
Således A+ den kan ha sex, åtta eller till och med tolv grannar. Antalet grannar som omger en jon i en kristall kallas koordinationsnummer (N.C). För varje N.C är en typ av kristallint arrangemang associerat, vilket i sin tur utgör en fast fas av saltet.
De symmetriska och facetterade kristallerna som ses i salterna beror på jämvikten som upprättats av attraktionsinteraktionerna (A+ B-) och avstötning (A+ TILL+, B- B-) elektrostatisk.
Träning
Men varför A + och B.-, eller Na+ och Cl-, bildar inte kovalenta bindningar av Na-Cl? Eftersom kloratomen är mycket mer elektronegativ än natriummetall, vilket också kännetecknas av att man lätt avstår från sina elektroner. När dessa element möts reagerar de exotermiskt för att producera bordssalt:
2Na (s) + Cltvå(g) => 2NaCl (s)
Två natriumatomer ger upp sin enda valenselektron (Na) till den diatomiska molekylen Cltvå, för att bilda Cl-anjoner-.
Samspelet mellan natriumkatjoner och kloridanjoner, även om de representerar en svagare bindning än kovalenta, kan hålla dem starkt förenade i det fasta ämnet; och detta faktum återspeglas i saltets höga smältpunkt (801ºC).
Metallisk bindning

Den sista typen av kemisk bindning är metallisk. Detta finns på alla metall- eller legeringsdelar. Det kännetecknas av att vara speciellt och annorlunda från de andra, på grund av det faktum att elektroner inte passerar från en atom till en annan, utan snarare, som ett hav, genom metallkristallen.
Således blandar metallatomer, för att säga koppar, deras valensorbitaler med varandra för att bilda ledningsband; genom vilka elektroner (s, p, d eller f) passerar runt atomerna och håller dem tätt ihop.
Beroende på antalet elektroner som passerar genom metallkristallen, orbitalerna som tillhandahålls för banden och förpackningen av dess atomer, kan metallen vara mjuk (som alkalimetaller), hård, glänsande eller en bra ledare av elektricitet och het.
Kraften som håller samman atomerna hos metaller, som de som utgör den lilla mannen i bilden och hans bärbara dator, är större än salterna.
Detta kan verifieras experimentellt eftersom saltkristallerna kan delas i flera halvor före en mekanisk kraft; medan en metalldel (som består av mycket små kristaller) är deformerad.
Exempel på länkar
Följande fyra föreningar omfattar de typer av förklarade kemiska bindningar:
-Natriumfluorid, NaF (Na+F-): jonisk.
-Natrium, Na: metalliskt.
-Fluor, Ftvå (F-F): icke-polär kovalent, på grund av det faktum att det finns en noll AE mellan båda atomerna eftersom de är identiska.
-Vätefluorid, HF (H-F): polär kovalent, eftersom fluor i denna förening är mer elektronegativ än väte.
Det finns föreningar, som vitamin B12, som har både polära och joniska kovalenta bindningar (i den negativa laddningen av dess fosfatgrupp -PO4--). I vissa komplexa strukturer, som metallkluster, kan alla dessa typer av länkar till och med samexistera.
Matter erbjuder i alla sina manifestationer exempel på kemiska bindningar. Från stenen längst ner i en damm och vattnet som omger den, till paddorna som skakar vid dess kanter.
Även om bindningarna kan vara enkla, gör antalet och det rumsliga arrangemanget av atomerna i molekylstrukturen plats för en rik mångfald av föreningar..
Betydelsen av den kemiska bindningen
Vad är betydelsen av den kemiska bindningen? Det oberäknliga antalet konsekvenser som frånvaron av kemisk bindning skulle släppa lös lyfter fram dess enorma betydelse i naturen:
-Utan den skulle det inte finnas färger, eftersom dess elektroner inte skulle absorbera elektromagnetisk strålning. Damm- och ispartiklarna i atmosfären skulle försvinna och därför skulle himmelens blå färg bli mörk..
-Kol kunde inte bilda sina oändliga kedjor, från vilka biljoner organiska och biologiska föreningar härrör.
-Proteiner kunde inte ens definieras i deras ingående aminosyror. Socker och fetter skulle försvinna, liksom alla kolföreningar i levande organismer.
-Jorden skulle lämnas utan atmosfär, för i avsaknad av kemiska bindningar i dess gaser skulle det inte finnas någon kraft att hålla ihop dem. Det skulle inte heller finnas den minsta intermolekylära interaktionen mellan dem.
-Bergen kan försvinna, eftersom deras stenar och mineraler, även om de är tunga, inte kunde innehålla sina atomer packade inuti sina kristallina eller amorfa strukturer..
-Världen skulle bestå av ensamma atomer som inte kunde bilda fasta eller flytande ämnen. Detta skulle också resultera i att all materiaomvandling försvinner; det vill säga det skulle inte finnas någon kemisk reaktion. Bara flyktiga gaser överallt.
Referenser
- Harry B. Gray. (1965). Elektroner och kemisk bindning. W.A. BENJAMIN, INC. P 36-39.
- Whitten, Davis, Peck & Stanley. Kemi. (8: e upplagan). CENGAGE Learning, s 233, 251, 278, 279.
- Nave R. (2016). Kemisk bindning. Återställd från: hyperphysics.phy-astr.gsu.edu
- Kemiska bindningstyper. (3 oktober 2006). Hämtad från: dwb4.unl.edu
- Bildning av kemiska bindningar: Elektronernas roll. [PDF]. Återställd från: cod.edu
- CK-12 Foundation. (s.f.). Bildning av energi och kovalent bindning. Återställd från: chem.libretexts.org
- Quimitube. (2012). Koordinat eller dativ kovalent bindning. Återställd från: quimitube.com


Ingen har kommenterat den här artikeln än.