
Aluminiumfosfat (AlPO4) struktur, egenskaper, produktion, användningsområden

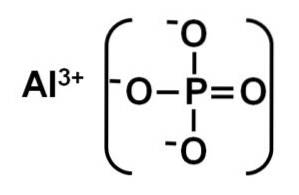
De aluminiumfosfat är en oorganisk fast substans bildad av en aluminiumjon Al3+ och en fosfatjon PO43-. Dess kemiska formel är AlPO4. Det är ett vitt fast ämne vars kristallstruktur liknar den för kiseldioxid SiOtvå. Det är olösligt i vatten.
Det kan erhållas från aluminiumoxid (AltvåELLER3) och fosforsyra (H3PO4). Det kan också erhållas utgående från vattenlösningar av aluminiumklorid (AlCl3och natriumfosfat (Na3PO4).

Aluminiumfosfat har en mycket hög smältpunkt, varför det används i stor utsträckning som en komponent i eldfast keramik, det vill säga keramik som tål mycket höga temperaturer..
Det används också som ett antacida för magen, i blandningar för reparation av tänder och som ett adjuvans för vacciner, det vill säga för att stimulera kroppens immunsvar.
Vissa eldfasta betongdelar har AlPO4 i sin sammansättning, vilket ökar de mekaniska och höga temperaturstödegenskaperna för denna typ av cement.
Det har använts som ett skyddande skydd för att förhindra att brännbara material som vissa polymerer brinner.
Artikelindex
- 1 Struktur
- 2 Nomenklatur
- 3 fastigheter
- 3.1 Fysiskt tillstånd
- 3.2 Molekylvikt
- 3.3 Smältpunkt
- 3.4 Densitet
- 3.5 Löslighet
- 3.6 Övriga egenskaper
- 4 Skaffa
- 5 Använd i keramik
- 5.1 Tillverkning av aluminiumfosfatkeramik
- 6 Andra användningsområden
- 6.1 Vid erhållande av betong
- 6.2 I tandcement
- 6.3 I vacciner
- 6.4 Som ett flamskyddsmedel i polymerer
- 7 Referenser
Strukturera
AlPO4 Den bildas av en aluminiumkatjon Al3+ och en fosfatanjon PO43-.
Kristallint aluminiumfosfat kallas också berlinit eller alfa-fas (α-AlPO4) och dess kristaller liknar kvarts.

Alfa-fasen i aluminiumfosfat är ett fast ämne som bildas av ett kovalent nätverk av PO tetraeder4 och AlPO4 som alternerar och är kopplade av syreatomer.
Denna struktur är isomorf med kiseldioxid, det vill säga den har samma form som kiseldioxid SiOtvå.
Nomenklatur
- Aluminiumfosfat
- Aluminiummonofosfat
- Aluminiumsalt av fosforsyra.
Egenskaper
Fysiskt tillstånd
Fast vit kristallin.
Molekylvikt
121,93 g / mol
Smältpunkt
1800 ºC
Densitet
2,56 g / cm3
Löslighet
Olöslig i vatten
Andra egenskaper
AlPO: s struktur4 är mycket lik kiseldioxid SiOtvå, så det delar många fysiska och kemiska egenskaper hos detta.
Aluminiumfosfat är ett mycket eldfast material, det vill säga det motstår mycket höga temperaturer utan att ändra sitt fysiska tillstånd eller struktur och utan att sönderdelas.
AlPO4 kristallin eller berlinit vid upphettning omvandlas till en struktur av tridymit och sedan av kristobalit, andra former av denna förening som liknar kiseldioxid SiOtvå.

Erhållande
Aluminiumfosfat AlPO4 kan erhållas genom reaktionen mellan fosforsyra H3PO4 och aluminiumoxid AltvåELLER3. Temperaturapplikation krävs, till exempel mellan 100 och 150 ° C.
TilltvåELLER3 + 2 timmar3PO4 = 2 AlPO4 + 3 HtvåELLER
Det kan också erhållas genom sammanfogning av en vattenlösning av aluminiumklorid AlCl3 med en vattenlösning av natriumfosfat Na3PO4:
AlCl3 + Na3PO4 = AlPO4 + 3 NaCl
Använd i keramik
Aluminiumfosfat AlPO4 återfinns ofta i konstruktionen av aluminiumoxidkeramik.
Keramik med hög aluminiumoxidhalt är ett av materialen som på grund av sin hårdhet används i applikationer där det krävs att motstå höga belastningar och svåra förhållanden..
Denna typ av keramik är motståndskraftig mot korrosion, miljöer med hög temperatur, mot närvaro av het ånga eller mot reducerande atmosfärer såsom kolmonoxid (CO)..
Aluminiumoxidkeramik har också låg elektrisk och värmeledningsförmåga, varför det används för att tillverka eldfasta tegelstenar och elektriskt isolerande komponenter..

Eftersom aluminiumfosfat bildas vid en mycket lägre temperatur än kiseldioxid SiOtvå, dess produktion är billigare, vilket utgör en fördel vid tillverkning av keramik som är lämplig för krävande tjänster.
Keramisk tillverkning av aluminiumfosfat
Al-aluminiumoxid användstvåELLER3 och fosforsyra H3PO4 i vattenhaltigt medium.
Det föredragna bildnings-pH-värdet är 2-8, eftersom det finns ett överflöd av upplösta fosforsyrasorter, såsom HtvåPO4- och HPO4två-. Vid surt pH är koncentrationen av Al-joner3+ är hög, kommer från upplösningen av aluminiumoxid AltvåELLER3.
Först bildas en hydratiserad aluminiumdifosfat trihydrogengel AlH.3(PO4)två.HtvåELLER:
Till3+ + HtvåPO4- + HPO4två- + HtvåO ⇔ AlH3(PO4)3.HtvåELLER
Det kommer emellertid en tid då lösningens pH sjunker och blir neutralt, där aluminiumoxiden AltvåELLER3 den har låg löslighet. Vid denna tidpunkt bildar den olösliga aluminiumoxiden ett skikt på partiklarnas yta, vilket förhindrar att reaktionen fortsätter..
Därför är det nödvändigt att öka aluminiumoxidens löslighet och detta uppnås genom försiktig upphettning. Vid upphettning till 150 ° C fortsätter gelén reaktionen med aluminiumoxid AltvåELLER3 släppa ut vatten och kristallin berlinit (alfa-AlPO4).
TilltvåELLER3 + 2 AlH3(PO4)3.HtvåO → AlPO4 + 4 timmartvåELLER
Berliniten binder de enskilda partiklarna och bildar keramiken.
Andra användningsområden
AlPO4 Det används som ett antacida, som ett adsorbent, som en molekylsikt, som ett katalysatorbärare och som en beläggning för att förbättra motståndet mot hetkorrosion. Nedanför andra applikationer.
Vid erhållande av betong
Aluminiumfosfat är en ingrediens i eldfast betong eller värmebeständig betong.
Det ger utmärkta mekaniska och brytningsegenskaper för dessa betongdelar, såsom värmebeständighet. I temperaturområdet mellan 1400-1600 ° C är cellulär betong baserad på aluminiumfosfat ett av de mest effektiva materialen som värmeisolator..
Det kräver inte torkning, dess härdning uppnås genom en självförökande exoterm reaktion. Det är möjligt att förbereda tegel av detta material av vilken form och storlek som helst.
I tandcement
Aluminiumfosfat är en del av tandcement eller material som används för att läka förfallna tänder.
I tandcement används aluminiumoxid som moderator för syrabasreaktioner, där den dämpande effekten beror på bildandet av aluminiumfosfat på partiklarna i andra material..
Dessa cement har en mycket hög motståndskraft mot kompression och spänning, vilket beror på närvaron av aluminiumfosfat.
I vacciner
AlPO4 Det har använts i många år i olika humana vacciner för att förbättra kroppens immunsvar. Det sägs att AlPO4 det är ett "adjuvans" för vacciner. Mekanismen är fortfarande inte väl förstådd.
Det är känt att den immunstimulerande effekten av AlPO4 det beror på processen för adsorption av antigenet till adjuvanset, det vill säga på det sätt det fäster vid det. Ett antigen är en förening som vid inträde i kroppen genererar bildandet av antikroppar för att bekämpa en specifik sjukdom.
Antigener kan adsorberas till AlPO4 genom elektrostatiska interaktioner eller genom bindning med ligander. De adsorberas på ytan av adjuvanset.
Man tror vidare att partikelstorleken hos AlPO4 det har också inflytande. Ju mindre partikelstorlek antikroppssvaret är större och längre..
Som ett flamskyddsmedel i polymerer
AlPO4 Det har använts som brandskyddsmedel och för att förhindra förbränning eller förbränning av vissa polymerer.
Tillägget av AlPO4 till en polypropenpolymer som redan har ett flamskyddsmedel orsakar en synergistisk effekt mellan båda retarderna, vilket innebär att effekten är mycket större än för båda brandskyddsmedlen separat.
När polymeren utsätts för förbränning eller bränns i närvaro av AlPO4, ett aluminiummetafosfat bildas som tränger igenom den förkolnade ytan och fyller porerna och sprickorna i detta.
Detta leder till bildandet av ett mycket effektivt skyddande skydd för att förhindra förbränning eller förbränning av polymeren. Med andra ord AlPO4 tätar förkolnad yta och förhindrar att polymeren brinner.

Referenser
- Abyzov, V.A. (2016). Lätt eldfast betong baserat på aluminium-magnesium-fosfatbindemedel. Procedia Engineering 150 (2016) 1440-1445. Återställd från sciencedirect.com.
- Wagh, A.S. (2016). Aluminiumfosfatkeramik. In Chemically Bonded Phosphate Ceramics (andra upplagan). Kapitel 11. Återställd från sciencedirect.com.
- Mei, C. et al. (2019). Aluminiumfosfatvaccinadjuvans: Analys av sammansättning och storlek med off-line och in-line verktyg. Comput Struct Biotechnol J. 2019; 17: 1184-1194. Återställd från ncbi.nlm.nih.gov.
- Qin, Z. et al. (2019). Synergistisk barriäreffekt av aluminiumfosfat på flamskyddsmedel polypropen baserat på ammoniumpolyfosfat / dipentaerytritolsystem. Material och design 181 (2019) 107913. Återställd från sciencedirect.com.
- Vrieling, H. et al. (2019). Stabiliserade aluminiumfosfatnanopartiklar som används som vaccinadjuvans. Kolloider och ytor B: Biointerfaces 181 (2019) 648-656. Återställd från sciencedirect.com.
- Schaefer, C. (2007). Gastrointestinala läkemedel. Antacida. In Drugs During Pregnancy and Lactation (Andra upplagan). Återställd från sciencedirect.com.
- .



Ingen har kommenterat den här artikeln än.