
Sammanhållningskraft

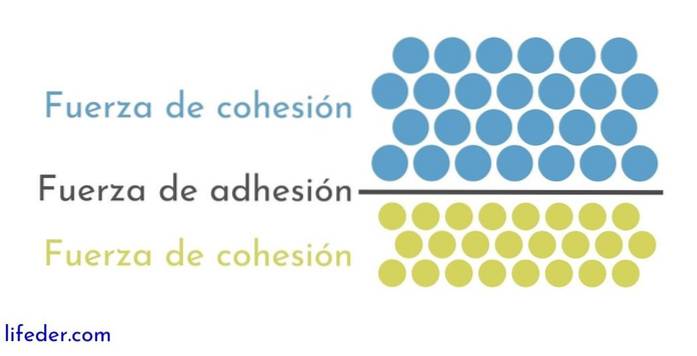
Vad är sammanhållningskrafter?
De sammanhållningskrafter de är de intermolekylära attraktionskrafterna som håller molekyler ihop. Beroende på sammanhållningskrafternas intensitet är ett ämne i fast, flytande eller gasformigt tillstånd. Värdet av sammanhållningskrafterna är en inneboende egenskap hos varje substans.
Denna egenskap är relaterad till formen och strukturen hos molekylerna för varje substans. Ett viktigt kännetecken för sammanhållningskrafterna är att de minskar snabbt med ökande avstånd. Därefter kallas sammanhållningskrafter de attraktionskrafter som uppstår mellan molekylerna i samma substans.
De motbjudande krafter är de som härrör från partiklarnas kinetiska energi (energi på grund av rörelse). Denna energi får molekylerna att vara ständigt i rörelse. Intensiteten hos denna rörelse är direkt proportionell mot temperaturen vid vilken ämnet finns..
För att orsaka förändring av ett ämnes tillstånd är det nödvändigt att höja temperaturen genom överföring av värme. Detta får substansens frånstötningskrafter att öka, vilket i fallet kan hamna förutsatt att tillståndsförändringen sker..
Å andra sidan är det viktigt och nödvändigt att skilja mellan sammanhållning och vidhäftning:
- Sammanhållning beror på de attraktiva krafterna som uppstår mellan angränsande partiklar av samma ämne.
- Vidhäftning är resultatet av interaktionen mellan olika ämnen eller kroppar.
Dessa två krafter verkar relaterade till olika fysiska fenomen som påverkar vätskor, så en god förståelse för båda är viktigt..
Sammanhållningskrafter i fasta ämnen, vätskor och gaser

I fasta ämnen
I allmänhet är sammanhållningskrafterna mycket fasta i fasta ämnen och de förekommer intensivt i de tre rymdriktningarna..
På detta sätt, om en yttre kraft appliceras på en fast kropp, sker endast små förskjutningar av molekylerna i förhållande till varandra..
Dessutom, när den yttre kraften försvinner, är sammanhållningskrafterna tillräckligt starka för att återföra molekylerna till sin ursprungliga position, och återhämta sig positionen innan kraften appliceras..
I vätskor
Tvärtom, i vätskor är sammanhållningskrafterna bara höga i två av de rumsliga riktningarna, medan de är mycket svaga mellan vätskeskikten..
Således, när en kraft appliceras i en tangentiell riktning på en vätska, bryter denna kraft de svaga bindningarna mellan skikten. Detta får vätskans lager att glida över varandra..
Senare, när kraftens applicering är klar, har inte sammanhållningskrafterna tillräckligt med kraft för att återföra vätskans molekyler till sin ursprungliga position..
Dessutom reflekteras sammanhållning i vätskor i ytspänningar orsakade av en obalanserad kraft riktad mot det inre av vätskan, som verkar på ytmolekylerna..
På samma sätt observeras kohesion också när övergången från flytande tillstånd till fast tillstånd sker på grund av effekten av kompression av vätskans molekyler..
I gaser
I gaser är sammanhållningskrafterna försumbara. På detta sätt är gasmolekylerna i konstant rörelse, eftersom sammanhållningskrafterna i deras fall inte kan hålla dem bundna ihop..
Av denna anledning kan sammanhållningskrafterna i gaser endast uppskattas när flytande processen äger rum, vilket äger rum när de gasformiga molekylerna komprimeras och de attraktiva krafterna är tillräckligt starka för att producera tillståndets övergång..
Exempel på sammanhållningskrafter
Sammanhängande krafter kombineras ofta med vidhäftningskrafter för att ge upphov till vissa fysikaliska och kemiska fenomen.
Till exempel förklarar sammanhållningskrafter tillsammans med vidhäftningskrafter några av de vanligaste fenomenen som förekommer i vätskor; är fallet med menisk, ytspänning och kapillaritet.
Därför, när det gäller vätskor, är det nödvändigt att skilja mellan sammanhållningskrafterna, som uppstår mellan molekylerna i samma vätska; och de av vidhäftning, som förekommer mellan molekylerna i vätskan och det fasta ämnet.
Ytspänning

Ytspänning är den kraft som uppstår tangentiellt och per längdenhet vid kanten av den fria ytan av en vätska som är i jämvikt. Denna kraft drar samman vätskans yta.
I slutändan uppstår ytspänning eftersom krafterna i vätskans molekyler är olika på vätskans yta än på insidan..
Menisk
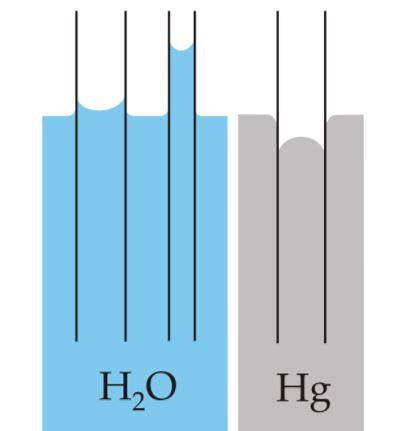
Menisk är krökningen som skapas på ytan av vätskor när de är inneslutna i en behållare. Denna kurva produceras av den effekt som ytan på behållaren som innehåller den har på vätskan..
Kurvan kan vara konvex eller konkav, beroende på om kraften mellan vätskans molekyler och behållarens de är attraktiva - vilket är fallet med vatten och glas - eller är motbjudande, som sker mellan kvicksilver och glas..
Kapillaritet

Kapillaritet är en egenskap hos vätskor som gör att de kan stiga upp eller ner genom ett kapillärrör. Det är egenskapen som delvis tillåter ökningen av vatten inuti växterna.
En vätska stiger upp i kapillärröret när sammanhållningskrafterna är mindre än vidhäftningskraften mellan vätskan och rörets väggar. På detta sätt kommer vätskan att fortsätta att stiga tills ytans spänningsvärde är lika med vätskans vikt i kapillärröret..
Tvärtom, om sammanhållningskrafterna är större än vidhäftningskrafterna, kommer ytspänningen att sänka vätskan och formen på dess yta blir konvex..
Referenser
- Sammanhållning (kemi) (n.d.). På Wikipedia. Återställd från en.wikipedia.org.
- Ytspänning (n.d.). På Wikipedia. Återställd från en.wikipedia.org.
- Kapillaritet (n.d.). På Wikipedia. Återställd från es.wikipedia.org.
- Ira N. Levine; "Fysikokemi" Volym 1; Femte upplagan; 2004; Mc Graw Hillm.
- Moore, John W. Stanitski, Conrad L.; Jurs, Peter C. (2005). Kemi: Molekylär vetenskap. Belmont, Kalifornien: Brooks / Cole.
- White, Harvey E. (1948). Modern College Physics. van Nostrand.



Ingen har kommenterat den här artikeln än.