
Hydraskartegenskaper, nomenklatur, användningsområden och exempel

De hydracider eller binära syror är föreningar lösta i vatten som består av väte och ett icke-metalliskt grundämne: vätehalogenider. Dess allmänna kemiska formel kan uttryckas som HX, där H är väteatomen och X är det icke-metalliska grundämnet..
X kan tillhöra grupp 17, halogenerna eller till elementen i grupp 16 utan att inkludera syre. Till skillnad från oxosyror saknar syror syre. Eftersom hydrocider är kovalenta eller molekylära föreningar måste H-X-bindningen beaktas. Detta är av stor betydelse och definierar egenskaperna hos varje hydrat..
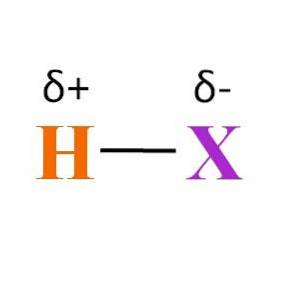
Vad sägs om H-X-bindningen? Som framgår av bilden ovan finns det en permanent dipolmomentprodukt av de olika elektronegativiteterna mellan H och X. Eftersom X vanligtvis är mer elektronegativ än H, lockar det sitt elektroniska moln och slutar med en negativ partiell laddning δ-.
Å andra sidan, genom att ge en del av sin elektrontäthet till X, hamnar det med en positiv partiell laddning δ +. Ju mer negativ δ-, desto rikare är elektroner X och ju större är elektronbristen hos H. Därför, beroende på vilket element X är, kan en hydrid vara mer eller mindre polär.
Bilden avslöjar också hydrocidernas struktur. H-X är en linjär molekyl som kan interagera med en annan i ena änden. Ju mer polar HX är, desto starkare eller affinitet kommer dess molekyler att interagera med. Som ett resultat kommer dess kok- eller smältpunkter att öka.
Emellertid är H-X - H-X-interaktionerna fortfarande svaga nog för att ge upphov till en fast hydrat. Av denna anledning är de gasformiga ämnen under tryck och omgivningstemperatur. Med undantag för HF, som avdunstar över 20 ° C.
Varför? Eftersom HF kan bilda starka vätebindningar. Medan de andra hydrociderna, vars icke-metalliska element är mindre elektronegativa, kan de knappast befinna sig i vätskefasen under 0 ° C. HCl kokar till exempel vid cirka -85 ° C.
Är hydraidsyror sura ämnen? Svaret ligger i den positiva partiella laddningen δ + på väteatomen. Om δ + är mycket stor eller H-X-bindningen är mycket svag, kommer HX att vara en stark syra; som med alla vätesyror i halogener, när deras respektive halogenider har lösts i vatten.
Artikelindex
- 1 Funktioner
- 1.1 Fysisk
- 1.2 Kemi
- 2 Nomenklatur
- 2.1 Vattenfri form
- 2.2 I vattenlösning
- 3 Hur bildas de??
- 3.1 Direkt upplösning av vätehalogenider
- 3.2 Upplösning av salter av icke-metaller med syror
- 4 användningsområden
- 4.1 Rengöringsmedel och lösningsmedel
- 4.2 Syrakatalysatorer
- 4.3 Reagenser för syntes av organiska och oorganiska föreningar
- 5 Exempel
- 5.1 HF, fluorvätesyra
- 5.2 H2S, vätesulfid
- 5.3 HCl, saltsyra
- 5,4 HBr, bromvätesyra
- 5,5 H2Te, tellvätesyra
- 6 Referenser
Egenskaper
Fysisk
-Synligt är alla hydrocider transparenta lösningar, eftersom HX är mycket lösliga i vatten. De kan ha gulaktiga toner enligt koncentrationerna av upplöst HX.
-De är rökare, vilket innebär att de avger täta, frätande och irriterande ångor (vissa av dem är till och med illamående). Detta beror på att HX-molekylerna är mycket flyktiga och interagerar med vattenångan i mediet som omger lösningarna. Vidare är HX i vattenfria former gasformiga föreningar..
-Vattenvätskor är bra ledare för elektricitet. Även om HX är gasformiga under atmosfäriska förhållanden frigör de joner (när de löses i vatten)+X-), som möjliggör passage av elektrisk ström.
-Kokpunkterna är högre än de vattenfria formerna. Det vill säga, HX (ac), som betecknar hydrat, kokar vid temperaturer över HX (g). Till exempel kokar väteklorid, HCl (g) vid -85 ° C, men klorvätesyra, dess saltsyra, runt 48 ° C..
Varför? Eftersom de gasformiga HX-molekylerna är omgivna av vatten. Två typer av interaktioner kan förekomma samtidigt: vätebindningar, HX - HtvåO - HX, eller jonlösning, H3ELLER+(ac) och X-(ac). Detta faktum är direkt relaterat till de kemiska egenskaperna hos hydracider..
Kemisk
Hydracider är mycket sura lösningar, så de har sura protoner H3ELLER+ tillgängliga för att reagera med andra ämnen. Var gör H3ELLER+? Från väteatomen med en positiv partiell laddning δ +, som dissocieras i vatten och slutar kovalent införlivas i en vattenmolekyl:
HX (aq) + HtvåO (l) <=> X-(ac) + H3ELLER+(ac)
Observera att ekvationen motsvarar en reaktion som skapar en jämvikt. När bildandet av X-(ac) + H3ELLER+(ac) är termodynamiskt mycket gynnad, HX kommer att släppa sin sura proton i vatten; och sedan den här, med H3ELLER+ som sin nya "bärare" kan den reagera med en annan förening, även om den senare inte är en stark bas.
Ovanstående förklarar de sura egenskaperna hos hydracider. Detta är fallet för all HX upplöst i vatten; men vissa genererar surare lösningar än andra. För vad är det här? Anledningarna kan vara mycket komplicerade. Inte alla HX (ac) gynnar den främre jämvikten mot höger, det vill säga mot X-(ac) + H3ELLER+(ac).
Aciditet
Och undantaget observeras i fluorvätesyra, HF (aq). Fluor är mycket elektronegativ, därför förkortar det H-X-bindningens avstånd, vilket stärker det mot dess nedbrytning genom vattenverkan..
På samma sätt har HF-bindningen mycket bättre överlappning av atomradie skäl. Å andra sidan är H-Cl-, H-Br- eller H-I-bindningarna svagare och tenderar att dissocieras helt i vatten, så att de bryter balansen ovan..
Detta beror på att de andra halogenerna eller kalkogenerna (till exempel svavel) har större atomradier och därmed större orbitaler. Följaktligen uppvisar H-X-bindningen en sämre omloppsöverlappning då X är större, vilket i sin tur påverkar syrakraften vid kontakt med vatten..
På detta sätt är den minskande syraordningen för vätesyrorna i halogenerna följande: HF< HCl Hur heter hydrocider? I sina vattenfria former, HX (g), måste de nämnas som dikterats för vätehalogenider: lägga till suffixet -iden till slutet av deras namn. Till exempel består HI (g) av en halid (eller hydrid) bildad av väte och jod, därför är dess namn: joduroxe väte. Eftersom icke-metaller i allmänhet är mer elektronegativa än väte har det ett oxidationsnummer på +1. I NaH har å andra sidan väte ett oxidationsnummer -1. Detta är ett annat indirekt sätt att skilja molekylära hydrider från halogener eller vätehalogenider från andra föreningar.. När HX (g) kommer i kontakt med vatten representeras det som HX (ac) och sedan har vi hydrat. För att namnge hydraciden, HX (ac), måste suffixet -iden av dess vattenfria former ersättas med suffixet -hydric. Och de bör nämnas som syror i första hand. För ovanstående exempel benämns sålunda HI (ac) som: syrajodhydric. Vätgas kan bildas genom att helt enkelt lösa upp motsvarande vätehalogenider i vatten. Detta kan representeras av följande kemiska ekvation: HX (g) => HX (ac) HX (g) är mycket lösligt i vatten, så det finns ingen balans mellan löslighet, till skillnad från dess joniska dissociation för att frigöra sura protoner. Det finns emellertid en syntetisk metod som föredras eftersom den använder salter eller mineraler som råmaterial och löser dem vid låga temperaturer med starka syror.. Om bordssalt, NaCl, löses med koncentrerad svavelsyra inträffar följande reaktion: NaCl (s) + HtvåSW4(aq) => HCl (aq) + NaHSO4(ac) Svavelsyra donerar en av dess sura protoner till kloridanjonen Cl-, vilket omvandlar det till saltsyra. Väteklorid, HCl (g), kan fly från denna blandning eftersom den är mycket flyktig, speciellt om koncentrationen i vatten är mycket hög. Det andra salt som produceras är natriumsyrasulfat, NaHSO4. Ett annat sätt att producera det är att ersätta svavelsyra med koncentrerad fosforsyra: NaCl (s) + H3PO4(aq) => HCl (aq) + NaHtvåPO4(ac) H3PO4 reagerar på samma sätt som HtvåSW4, producerar saltsyra och natriumsyrafosfat. NaCl är källan till anjonen Cl-, så att för att syntetisera de andra hydraiderna, behövs salter eller mineraler innehållande F-, Br-, Jag-, Stvå-, etc. Men användningen av HtvåSW4 eller H3PO4 det beror på dess oxidationsstyrka. HtvåSW4 Det är ett mycket starkt oxidationsmedel, så att det oxiderar även Br- och jag- till deras molekylära former Brtvå och jagtvå; den första är en rödaktig vätska och den andra en lila fast substans. Därför är H3PO4 representerar det föredragna alternativet i sådana synteser. Hydracids används i huvudsak för att lösa upp olika typer av ämnen. Detta beror på att de är starka syror och kan rengöra alla ytor med måtta.. Dess sura protoner tillsätts föreningarna med föroreningar eller smuts, vilket gör dem lösliga i det vattenhaltiga mediet och dras sedan av vattnet. Beroende på den kemiska beskaffenheten hos nämnda yta kan en hydrat eller en annan användas. Till exempel kan fluorvätesyra inte användas för att rengöra glas eftersom det löser upp dem på plats. Saltsyra används för att ta bort fläckar från poolplattor. De kan också lösa stenar eller fasta prover och användas sedan för analytiska eller produktionsändamål i små eller stora skalor. Vid jonbyteskromatografi används utspädd saltsyra för att rengöra kolonnen från kvarvarande joner.. Vissa reaktioner kräver mycket sura lösningar för att påskynda dem och minska tiden de äger rum. Det är här hydrociderna kommer in. Ett exempel på detta är användningen av hydrojodsyra vid syntesen av isättika. Oljeindustrin behöver även hydrat i raffinaderier. Hydracider ger inte bara sura protoner utan också deras respektive anjoner. Dessa anjoner kan reagera med en organisk eller oorganisk förening för att bilda en specifik halid. På detta sätt kan de syntetiseras: fluorider, klorider, jodider, bromider, selenider, sulfider och andra föreningar mer. Dessa halider kan ha mycket olika applikationer. Till exempel kan de användas för att syntetisera polymerer, såsom teflon; eller mellanhänder, från vilka halogenatomerna kommer att införlivas i molekylära strukturer hos vissa läkemedel. Antag att molekylen CH3CHtvåOH, etanol, reagerar med HCl för att bilda etylklorid: CH3CHtvåOH + HCl => CH3CHtvåCl + HtvåELLER Var och en av dessa reaktioner döljer en mekanism och många aspekter som beaktas i organiska synteser.. Det finns inte många exempel tillgängliga för hydracider, eftersom antalet möjliga föreningar naturligt är begränsat. Av denna anledning listas några ytterligare hydraider nedan med respektive nomenklatur (förkortningen (ac) ignoreras): Binär hydracid vars HF-molekyler bildar starka vätebindningar, så att det i vatten är en svag syra. Till skillnad från de hydracider som betraktats fram till dess är det polyatomiskt, det vill säga det har mer än två atomer, men det fortsätter att vara binärt eftersom det är två element: svavel och väte.. Dess vinklade HS-H-molekyler bildar inte märkbara vätebindningar och kan detekteras av deras karakteristiska ruttna ägglukt.. En av de mest kända syrorna i populärkulturen. Det är till och med en del av magsaftens sammansättning, som finns i magen, och tillsammans med matsmältningsenzymer bryter de ner maten. I likhet med hydrojodsyra består den i gasfasen av linjära H-Br-molekyler, som dissocieras till H-joner+ (H3ELLER+) och Br- när de kommer in i vattnet. Även om tellur har en viss metallisk karaktär, avger dess hydraidsyra obehagliga och mycket giftiga ångor, såsom väteselenid.. Liksom de andra hydrociderna av kalkogenider (från grupp 16 i det periodiska systemet) producerar den i lösning anjonen Tetvå-, så dess valens är -2.Nomenklatur
Vattenfri form
I vattenlösning
Hur bildas de?
Direkt upplösning av vätehalogenider
Upplösning av salter av icke-metaller med syror
Applikationer
Rengöringsmedel och lösningsmedel
Syrakatalysatorer
Reagenser för syntes av organiska och oorganiska föreningar
Exempel
HF, fluorvätesyra
HtvåS, vätesulfid
HCl, saltsyra
HBr, bromvätesyra
HtvåTe, saltsyra
Referenser



Ingen har kommenterat den här artikeln än.