
Berylliumhydrid (BeH2) struktur, egenskaper och användningsområden
De berylliumhydrid Det är en kovalent förening bildad mellan jordalkalimetallen beryllium och väte. Dess kemiska formel är BeHtvå, och eftersom den är kovalent, består den inte av Be-jonertvå+ inte heller H-. Det är, tillsammans med LiH, en av de lättaste metallhydriderna som kan syntetiseras.
Det produceras genom behandling av dimetylberyllium, Be (CH3)två, med litiumaluminiumhydrid, LiAlH4. Men BeHtvå renare erhålls från pyrolysen av di-tert-butylberyl, Be (C (CH3)3)två vid 210 ºC.

Som en enskild molekyl i gasform är den linjär i geometri, men i fast och flytande tillstånd polymeriserar den i grupper av tredimensionella nätverk. Det är ett amorft fast ämne under normala förhållanden och kan bli kristallint och uppvisa metalliska egenskaper under enormt tryck..
Det representerar en möjlig metod för lagring av väte, antingen som en källa till väte vid nedbrytning, eller som en fast absorberande gas. Men BeHtvå det är mycket giftigt och förorenande med tanke på berylliums mycket polariserande natur.
Artikelindex
- 1 Kemisk struktur
- 1.1 BeH2-molekyl
- 1.2 BeH2-kedjor
- 1.3 Tredimensionella nätverk av BeH2
- 2 fastigheter
- 2.1 Kovalent karaktär
- 2.2 Kemisk formel
- 2.3 Fysiskt utseende
- 2.4 Löslighet i vatten
- 2.5 Löslighet
- 2.6 Densitet
- 2.7 Reaktivitet
- 3 användningsområden
- 4 Referenser
Kemisk struktur
BeH-molekyltvå
Den första bilden visar en enda molekyl berylliumhydrid i gasform. Observera att dess geometri är linjär med H-atomerna åtskilda från varandra med en vinkel på 180 °. För att förklara denna geometri måste Be-atomen ha sp-hybridisering.
Beryllium har två valenselektroner, som är belägna i 2s orbital. Enligt valensbindningsteorin främjas en av elektronerna i 2s-banan energiskt till 2p-banan; och som en konsekvens kan du nu bilda två kovalenta bindningar med de två sp hybridorbitalerna.
Och hur är det med resten av Be: s fria orbitaler? Två andra rena, icke-hybridiserade 2p-orbitaler är tillgängliga. Med dem tomma, BeHtvå Det är en elektronbristande förening i gasform; och därför, när dess molekyler svalnar och klumpar ihop sig, kondenserar de och kristalliseras till en polymer.
BeH-kedjortvå
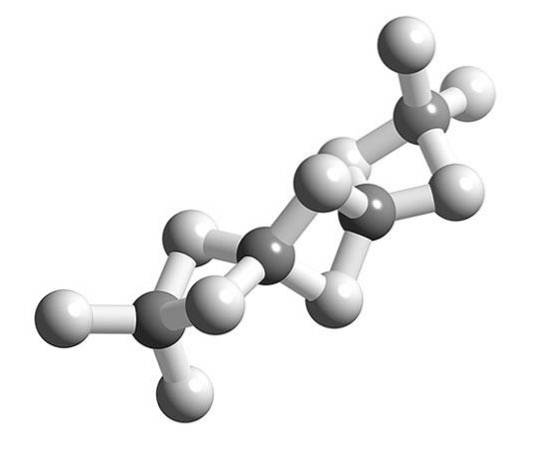
När BeH-molekylernatvå polymerisera upphör den omgivande geometrin hos Be-atomen att vara linjär och blir tetraedrisk.
Tidigare modellerades strukturen för denna polymer som om de vore kedjor med BeH-enhetertvå länkade med vätebindningar (övre bild, med kulorna i vita och gråaktiga toner). Till skillnad från vätebindningarna av dipol-dipolinteraktioner har de en kovalent karaktär.
I Be-H-Be-bron av polymeren fördelas två elektroner mellan de tre atomerna (länk 3c, 2e), som teoretiskt borde placeras med större sannolikhet kring väteatomen (är mer elektronegativ).
Å andra sidan lyckas Be omgiven av fyra H relativt fylla sin elektroniska vakans och fullborda sin valensoktet.
Här bleknar valensbindningsteorin för att ge en relativt korrekt förklaring. Varför? Eftersom väte bara kan ha två elektroner, och -H-bindningen skulle innebära deltagande av fyra elektroner.
Således för att förklara Be-H-broarnatvå-Be (två grå sfärer förenade med två vita sfärer) andra komplexa modeller av bindningen behövs, såsom de som tillhandahålls av molekylär orbitalteori.
Det har visat sig experimentellt att den polymera strukturen hos BeHtvå egentligen inte en kedja utan ett tredimensionellt nätverk.
Tredimensionella nätverk av BeHtvå

Den övre bilden visar ett avsnitt av det tredimensionella nätverket av BeHtvå. Observera att de gulgröna sfärerna, Be-atomerna, bildar en tetraeder som i kedjan; emellertid finns det i denna struktur ett större antal vätebindningar, och dessutom är den strukturella enheten inte längre BeHtvå men BeH4.
Samma strukturella enheter BeHtvå och BeH4 indikerar att det finns ett större överflöd av väteatomer i nätverket (4 H-atomer för varje Be).
Detta innebär att beryllium inom detta nätverk lyckas leverera sin elektroniska vakans ännu mer än inom en kedjeliknande polymerstruktur..
Och som den mest uppenbara skillnaden för denna polymer med avseende på den enskilda BeH-molekylentvå, är att Be måste nödvändigtvis ha en sp-hybridisering3 (vanligtvis) för att förklara tetraedriska och icke-linjära geometrier.
Egenskaper
Kovalent karaktär
Varför är berylliumhydrid en kovalent och nonjonisk förening? Hydriderna i de andra elementen i grupp 2 (Mr. Becamgbara) är joniska, det vill säga de består av fasta ämnen bildade av en katjon Mtvå+ och två hydridanjoner H- (MgHtvå, CaHtvå, Bahtvå). Därför är BeHtvå består inte av Betvå+ inte heller H- interagerar elektrostatiskt.
Katjonen varatvå+ den kännetecknas av sin höga polariserande kraft som förvränger de omgivande atommarnas elektroniska moln.
Som ett resultat av denna snedvridning anjonerna H- de tvingas bilda kovalenta bindningar; länkar, som är hörnstenen i de just förklarade strukturerna.
Kemisk formel
BeHtvå eller (BeHtvå) n
Fysiskt utseende
Färglös amorf fast substans.
Vattenlöslighet
Det sönderfaller.
Löslighet
Olöslig i dietyleter och toluen.
Densitet
0,65 g / cm3 (1,85 g / 1). Det första värdet kan avse gasfasen och det andra till det polymera fastämnet.
Reaktivitet
Reagerar långsamt med vatten men hydrolyseras snabbt av HCl för att bilda berylliumklorid, BeCltvå.
Berylliumhydrid reagerar med Lewis-baser, speciellt trimetylamin, N (CH3)3, för att bilda en dimeraddukt, med överbryggande hydrider.
Det kan också reagera med dimetylamin för att bilda trimer berylliumdiamid, [Be (N (CH3)två)två]3 och väte. Reaktionen med litiumhydrid, där H-jon- är Lewis-basen, bildar sekventiellt LIBeH3 och LitvåBeH4.
Applikationer
Berylliumhydrid kan representera ett lovande sätt att lagra molekylärt väte. När polymeren sönderdelas skulle den frigöra Htvå, som skulle fungera som raketbränsle. Från detta tillvägagångssätt skulle det tredimensionella nätverket lagra mer väte än kedjorna.
På samma sätt, som kan ses i bilden av nätverket, finns det porer som gör det möjligt att inhysa H-molekylerna.två.
I själva verket simulerar vissa studier hur sådan fysisk lagring skulle se ut i BeHtvå kristallin; det vill säga polymeren utsattes för enorma tryck och vad skulle vara dess fysikaliska egenskaper med olika mängder adsorberat väte.
Referenser
- Wikipedia. (2017). Berylliumhydrid. Återställd från: en.wikipedia.org
- Armstrong, D.R., Jamieson, J. & Perkins, P.G. Teori. Chim. Acta (1979) De elektroniska strukturerna av polymer berylliumhydrid och polymer borhydrid. 51: 163. doi.org/10.1007/BF00554099
- Kapitel 3: Berylliumhydrid och dess oligomerer. Återställd från: shodhganga.inflibnet.ac.in
- Vikas Nayak, Suman Banger och U. P. Verma. (2014). Studie av BeHs strukturella och elektroniska beteendetvå som väteförvaringsförening: En Ab Initio-metod. Conference Papers in Science, vol. 2014, artikel-ID 807893, 5 sidor. doi.org/10.1155/2014/807893
- Shiver & Atkins. (2008). Oorganisk kemi. I Elementen i grupp 1. (Fjärde upplagan). Mc Graw Hill.



Ingen har kommenterat den här artikeln än.