
Ammoniumhydroxidstruktur, egenskaper och användningsområden
De ammoniumhydroxid är en förening med molekylformeln NH4Åh åh5NO produceras genom upplösning av ammoniakgas (NH3) i vatten. Av denna anledning kallas det ammoniakvatten eller flytande ammoniak..
Det är en färglös vätska med en mycket intensiv och skarp lukt, som inte kan isoleras. Dessa egenskaper har ett direkt samband med NH-koncentrationen3 upplöst i vatten; koncentration som faktiskt, eftersom det är en gas, kan omfatta stora mängder av den upplöst i en liten volym vatten.
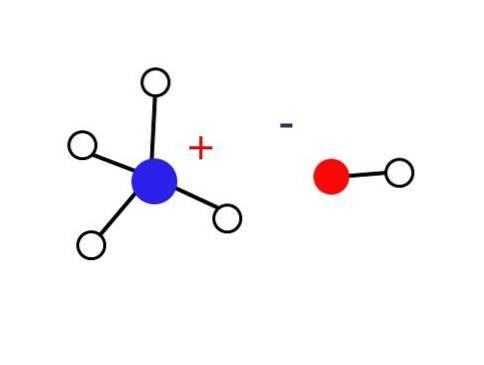
En betydligt liten del av dessa vattenlösningar består av NH-katjoner.4+ och OH-anjonerna-. Å andra sidan, i mycket utspädda lösningar eller i frysta fasta ämnen vid mycket låga temperaturer, kan ammoniak hittas i form av hydrater, såsom: NH3∙ HtvåEller, 2NH3∙ HtvåO och NH3∙ 2HtvåELLER.
Som ett märkligt faktum består Jupiters moln av utspädda lösningar av ammoniumhydroxid. Galileos rymdprob misslyckades dock med att hitta vatten i planetens moln, vilket kan förväntas på grund av den kunskap vi har om bildandet av ammoniumhydroxid; det vill säga de är NH-kristaller4OH helt vattenfri.
Ammoniumjonen (NH4+) produceras i den renala tubulära lumen genom förening av ammoniak och väte, utsöndrad av de renala tubulära cellerna. På samma sätt produceras ammoniak i renala tubulära celler i processen för transformation av glutamin till glutamat och i sin tur i omvandlingen av glutamat till a-ketoglutarat.
Ammoniak produceras industriellt med Haber-Bosch-metoden, där kväve- och vätgas reageras; med användning av järnjon, aluminiumoxid och kaliumoxid som katalysatorer. Reaktionen utförs vid höga tryck (150 - 300 atmosfärer) och höga temperaturer (400-500 ° C), med ett utbyte av 10-20%.
Ammoniak produceras i reaktionen, som när det oxiderar producerar nitrit och nitrat. Dessa är väsentliga för att erhålla salpetersyra och gödningsmedel såsom ammoniumnitrat..
Artikelindex
- 1 Kemisk struktur
- 1.1 Ammoniakis
- 2 Fysikaliska och kemiska egenskaper
- 2.1 Molekylformel
- 2.2 Molekylvikt
- 2.3 Utseende
- 2.4 Koncentration
- 2,5 Lukt
- 2.6 Smak
- 2.7 Tröskelvärde
- 2.8 Kokpunkt
- 2.9 Löslighet
- 2.10 Löslighet i vatten
- 2.11 Densitet
- 2.12 Ångdensitet
- 2.13 Ångtryck
- 2.14 Frätande verkan
- 2,15 pH
- 2.16 Dissociationskonstant
- 3 Nomenklatur
- 4 Löslighet
- 5 risker
- 5.1 Reaktivitet
- 6 användningsområden
- 6.1 I livsmedel
- 6.2 Terapi
- 6.3 Industriellt och diverse
- 6.4 Inom jordbruket
- 7 Referenser
Kemisk struktur
Som definitionen indikerar består ammoniumhydroxid av en vattenlösning av ammoniakgas. Därför finns det inom vätskan ingen annan definierad struktur än den för ett slumpmässigt arrangemang av NH-joner.4+ och OH- solvatiserad av vattenmolekyler.
Ammonium- och hydroxyljoner är produkter med en jämvikt mellan ammoniakhydrolys, så det är vanligt att dessa lösningar har en skarp lukt:
NH3(g) + HtvåO (l) <=> NH4+(ac) + OH-(ac)
Enligt den kemiska ekvationen skulle en hög minskning av vattenkoncentrationen flytta jämvikten till bildandet av mer ammoniak; när ammoniumhydroxiden upphettas kommer ammoniakångor att frigöras.
Av denna anledning NH-joner4+ och OH- misslyckas med att bilda en kristall under markförhållanden, vilket resulterar i den fasta basen NH4Åh existerar inte.
Nämnda fasta ämne bör endast bestå av elektrostatiskt interagerande joner (som visas på bilden).
Ammoniakis
Men under temperaturer långt under 0 ° C och omgiven av enorma tryck, som de som råder i kärnorna i isiga månar, fryser ammoniak och vatten. På detta sätt kristalliserar de till en fast blandning med olika stökiometriska förhållanden, det enklaste är NH3∙ HtvåO: ammoniakmonohydrat.
NH3∙ HtvåO och NH3∙ 2HtvåEller så är det ammoniakis, eftersom det fasta ämnet består av ett kristallint arrangemang av vatten- och ammoniakmolekyler kopplade till vätebindningar..
Med tanke på en förändring i T och P, enligt beräkningsstudier som simulerar alla fysiska variabler och deras effekter på dessa is, sker en övergång av en NH-fas.3∙ nHtvåEller till en NH-fas4Åh.
Därför är NH endast under dessa extrema förhållanden4OH kan existera som en produkt av en protonering i is mellan NH3 och HtvåELLER:
NH3(s) + HtvåDu) <=> NH4Åh s)
Observera att den här gången, till skillnad från ammoniakhydrolys, är de inblandade arterna i en fast fas. En ammoniakis som blir salt utan att ammoniak släpps ut.
Fysiska och kemiska egenskaper
Molekylär formel
NH4Åh åh5INTE
Molekylvikt
35,046 g / mol
Utseende
Det är en färglös vätska.
Koncentration
Upp till cirka 30% (för NH-joner4+ och OH-).
Odör
Mycket stark och skarp.
Smak
Tunnland.
Tröskelvärde
34 ppm för ospecifik detektering.
Kokpunkt
38 ºC (25%).
Löslighet
Finns endast i vattenlösning.
Vattenlöslighet
Blandbar i obegränsade proportioner.
Densitet
0,90 g / cm3 vid 25 ºC.
Ång-densitet
I förhållande till luften tagen som enhet: 0,6. Det vill säga det är mindre tätt än luft. Logiskt sett avser emellertid det rapporterade värdet ammoniak som en gas, inte dess vattenlösningar eller NH4Åh.
Ångtryck
2160 mmHg vid 25 ºC.
Frätande verkan
Den kan lösa upp zink och koppar.
pH
11,6 (IN lösning); 11,1 (lösning 0,1 N10,6 (0,01 N lösning).
Dissociationskonstant
pKb = 4,767; Kb = 1,71 x 10-5 vid 20 ºC
pKb = 4,751; Kb = 1774 x 10-5 vid 25 ° C.
Att höja temperaturen ökar nästan obegränsat ammoniumhydroxids basitet.
Nomenklatur
Vilka är alla vanliga och officiella namn som NH får?4ÅH? Enligt vad som fastställs av IUPAC är dess namn ammoniumhydroxid eftersom det innehåller hydroxylanjonen.
Ammonium är på grund av sin +1 laddning monovalent, så med hjälp av Stock-nomenklaturen heter det som: ammoniumhydroxid (I).
Även om användningen av termen ammoniumhydroxid är tekniskt felaktig, eftersom föreningen inte kan isoleras (åtminstone inte på jorden, som förklaras i detalj i första avsnittet).
Dessutom kallas ammoniumhydroxid ammoniakvatten och flytande ammoniak..
Löslighet
NH4OH existerar inte som ett salt under markförhållanden, det kan inte beräknas hur lösligt det är i olika lösningsmedel.
Emellertid skulle det förväntas vara extremt lösligt i vatten, eftersom dess upplösning skulle frigöra enorma mängder NH3. Teoretiskt sett skulle det vara ett fantastiskt sätt att lagra och transportera ammoniak.
I andra lösningsmedel som kan acceptera vätebindningar, såsom alkoholer och aminer, kan man förvänta sig att det också skulle vara mycket lösligt i dem. Här NH-katjonen4+ är en vätebindningsgivare och OH- fungerar som båda.
Exempel på dessa interaktioner med metanol skulle vara: H3N+-H - OHCH3 och HO- - HOCH3 (OHCH3 indikerar att syre tar emot vätebindningen, inte att metylgruppen är kopplad till H).
Risker
-Vid kontakt med ögonen orsakar det irritation som kan leda till ögonskador..
-Det är frätande. Därför kan det vid hudkontakt orsaka irritation och vid höga koncentrationer av reagenset orsakar det brännskador på huden. Upprepad kontakt av ammoniumhydroxid med huden kan göra att den blir torr, kliande och röd (dermatit)..
-Inandning av ammoniumhydroxiddimma kan orsaka akut irritation i luftvägarna, kännetecknad av kvävning, hosta eller andfåddhet. Långvarig eller upprepad exponering för ämnet kan leda till återkommande luftvägsinfektioner. Inandning av ammoniumhydroxid kan också orsaka irritation i lungorna..
-Exponering för höga koncentrationer av ammoniumhydroxid kan utgöra en medicinsk nödsituation eftersom vätskeuppbyggnad i lungorna (lungödem) kan uppstå..
-Koncentrationen på 25 ppm har tagits som en exponeringsgräns i en 8-timmars arbetsskift i en miljö där arbetaren utsätts för den skadliga effekten av ammoniumhydroxid.
Reaktivitet
-Förutom den potentiella hälsoskadan från exponering för ammoniumhydroxid finns det andra försiktighetsåtgärder som måste tas i beaktande när man arbetar med ämnet..
-Ammoniumhydroxid kan reagera med många metaller, såsom: silver, koppar, bly och zink. Det reagerar också med salterna av dessa metaller för att bilda explosiva föreningar och frigöra vätgas; vilket i sin tur är brandfarligt och explosivt.
-Det kan reagera våldsamt med starka syror, till exempel: saltsyra, svavelsyra och salpetersyra. Det reagerar också på samma sätt med dimetylsulfat och halogener..
-Reagerar med starka baser, såsom natriumhydroxid och kaliumhydroxid, vilket ger ammoniakgas. Detta kan verifieras genom att observera jämvikten i lösning, i vilken tillsatsen av OH-joner- flyttar jämvikt till NH-bildning3.
-Koppar- och aluminiummetaller, liksom andra galvaniserade metaller, bör inte användas vid hantering av ammoniumhydroxid på grund av dess frätande verkan på dem..
Applikationer
I mat
-Det används som tillsats i många livsmedel där det fungerar som ett jäsmedel, pH-kontroll och efterbehandlingsmedel för livsmedelsytan..
-Listan över livsmedel där ammoniumhydroxid används är omfattande och innehåller bakverk, ostar, choklad, godis och puddingar..
-Ammoniumhydroxid är listat som ett säkert ämne av FDA för livsmedelsbearbetning, så länge som fastställda standarder följs..
-I köttprodukter används det som ett antimikrobiellt medel, för att kunna eliminera bakterier som E. coli och reducera det till oupptäckbara nivåer. Bakterierna finns i tarmarna hos nötkreatur och anpassar sig till den sura miljön. Ammoniumhydroxid hindrar bakterietillväxt genom att reglera pH.
Terapeutik
-Ammoniumhydroxid har flera terapeutiska användningsområden, inklusive:
-10% -lösningen används som en stimulant för andningsreflexen
-Externt används det på huden för att behandla insektsbett och bett -Det fungerar i matsmältningssystemet som ett antacida och carminativt, det vill säga det hjälper till att eliminera gaser.
Dessutom används den som en lokal rubefacient för akut och kronisk muskuloskeletal smärta. Som en konsekvens av ammoniumhydroxids rubbaktiva verkan sker en lokal ökning av blodflödet, rodnad och irritation..
Industriell och diverse
-Det fungerar för att minska NOx (mycket reaktiva gaser som kväveoxid (NO) och kvävedioxid (NOtvå)) för batteriutsläpp och NOx-minskning av stackutsläpp.
-Den används som mjukgörare; färgadditiv och för ytbehandling.
-Ökar hårets porositet så att färgämnena i färgämnet får en större penetration, vilket ger en bättre finish.
-Ammoniumhydroxid används som ett antimikrobiellt medel vid behandling av avloppsvatten. Dessutom är det involverat i syntesen av kloramin. Detta ämne uppfyller en funktion som liknar klor vid rening av poolvatten, med fördelen att det är mindre giftigt.
-Det används som korrosionsinhibitor i petroleumsraffinering.
-Det används som rengöringsmedel i olika industriella och kommersiella produkter och används på olika ytor, inklusive: rostfritt stål, porslin, glas och ugn.
-Dessutom används den vid tillverkning av tvättmedel, tvålar, läkemedel och bläck..
I jordbruket
Även om det inte administreras direkt som gödningsmedel, uppfyller ammoniumhydroxid denna funktion. Ammoniak framställs av atmosfäriskt kväve med Haber-Bosch-metoden och transporteras kylt under kokpunkten (-33 ºC) till platserna för dess användning.
Den trycksatta ammoniak injiceras som ånga i jorden där den omedelbart reagerar med det edafiska vattnet och passerar i form av ammonium (NH4+), som kvarhålls i jordens katjonbytesplatser. Dessutom produceras ammoniumhydroxid. Dessa föreningar är en kvävekälla.
Tillsammans med fosfor och kalium utgör kväve triaden av de viktigaste växtnäringsämnena som är nödvändiga för deras tillväxt..
Referenser
- Ganong, W. F. (2002). Medicinsk fysiologi. 19: e upplagan. Modern manuell ledare.
- A. D. Fortes, J. P. Brodholt, I. G. Wood och L. Vocadlo. (2001). Ab initio-simulering av ammoniakmonohydrat (NH3∙ HtvåO) och ammoniumhydroxid (NH4ÅH). American Institute of Physics. J. Chem. Phys., Vol. 115, nr 15, 15.
- Helmenstine, Anne Marie, Ph.D. (6 februari 2017). Fakta om ammoniumhydroxid. Återställd från: thoughtco.com
- Pochteca Group. (2015). Ammoniumhydroxid. pochteca.com.mx
- NJ Hälsa. (s.f.). Faktablad om farligt ämne: Ammoniumhydroxid. [PDF]. Återställd från: nj.gov
- Kemilärare. (2018). Ammoniumhydroxid. Återställd från: chemistrylearner.com
- PubChem. (2018). Ammoniumhydroxid. Återställd från: pubchem.ncbi.nlm.nih.gov



Ingen har kommenterat den här artikeln än.