
Järn (II) hydroxidstruktur, egenskaper, användningsområden
De järn (II) hydroxid, även kallad järnhydroxid, det är en oorganisk förening med den kemiska formeln Fe (OH)två. Om din renhet är hög består din fasta substans bara av Fe-jonertvå+ och OH- i ett förhållande 2: 1; emellertid kan den innehålla vattenmolekyler och olika joniska arter, vilket ändrar position.
Den representerar den "reducerade" formen av den berömda rosten, en rödaktig yta som består av Fe-joner.3+; medan i grönaktig rost dominerar Fetvå+, bredvid OH- och annan mängd anjoner: CO3två-, SW4två-, INTE3- och halider (F-, Cl-,… ), till exempel. Resultatet, även om basen för denna gröna rost är Fe (OH)två, är att olika fasta ämnen erhålls.

I det dagliga livet kan denna hydroxid ses på vanliga platser. Till exempel har båten på bilden ovan yta täckt av grön rost (inte patina). Det finns tron (OH)två, men åtföljs av många joner från havets vågor.
Kemiskt sett är egenskaperna och användningen av detta material beroende av Fe-katjonen.två+ och dess tendens att oxideras för att bli Fe3+. Det är ett reduktionsmedel som reagerar snabbt med syre under grundläggande förhållanden. Därför måste den användas i inerta atmosfärer och i sura lösningar..
Artikelindex
- 1 Struktur av järn (II) hydroxid
- 1.1 Länkar
- 1.2 Dubbla lager hydroxid
- 1.3 Hydrater
- 1.4 Grön och röd rost
- 2 fastigheter
- 3 användningsområden
- 3.1 Kvalitativ organisk analys
- 3.2 Selenoxoanionreducerare
- 3.3 Dubbla lager material
- 4 Referenser
Struktur av järn (II) hydroxid
Länkar
Med tanke på endast Fe (OH)två ren, har ingenting annat än Fe-jonertvå+ och OH-.
Samspelet mellan dem måste i teorin vara joniskt till sin natur; varje Fe-katjontvå+ lockar två OH-anjoner-, vars icke-riktade attraktioner slutar upprätta en strukturell och repetitiv ordning som definierar en kristall; vilket i sin tur ger upphov till grönt rostdamm.
Problemet är att det finns en viss kovalent karaktär mellan båda jonerna, och därför kan en jonisk Fe-OH-bindning inte ignoreras. Med tanke på en delvis jonisk Fe-OH-bindning kan det förstås att de är grupperade i ett slags polymerskikt.
Dubbla lager hydroxid
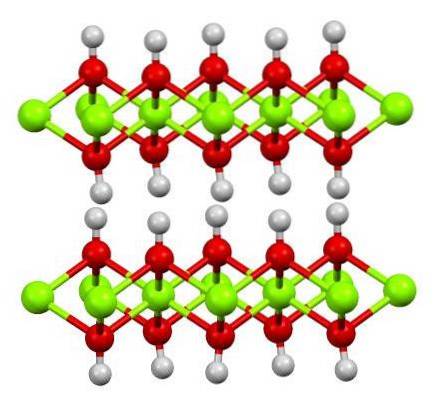
Strukturen för ren järnhydroxid visas ovan med en kul-och-stick-modell. Fe-katjonernatvå+ representeras av de ljusgröna sfärerna, medan OH-anjonerna- av de röda och vita kulorna. Lägg märke till hur Fe-jonerna inriktastvå+ tack vare interaktionerna (jonisk-kovalent) med OH-.
Varför kallas denna struktur dubbla hydroxidskikt? Själva bilden ger svaret: det finns två rader eller lager av OH- för var och en av trontvå+; det vill säga förhållandet 2: 1 Fe (OH) bibehållstvå nämndes i början.
Strukturenheter för Fe (OH)två är då dessa smörgåsar, där skikten av OH- de skulle komma för att representera bröden; negativt laddade bröd som därför misslyckas med att sätta ordentligt för att definiera en slående brun kristall.
Men å andra sidan raderar H-atomerna också och överskuggar varandra. Kommer ihåg begreppet polaritet och elektronegativitet, har dessa väten en liten positiv partiell laddning, δ +; som, även om de är svaga, kan ha en positiv zon där andra anjoner eller molekyler är inrymda.
Hydrater
När Fe (OH)två upplöses i vatten, dess molekyler samordnar med metallcentret i Fetvå+ för att bilda en komplex vattenhaltig: [Fe (HtvåELLER)4(ÅH)två]. Detta komplex har en oktaedrisk geometri eftersom den har sex ligander: fyra vattenmolekyler och två OH-molekyler.-. Men i hydratiserad järnhydroxid är bilden lite annorlunda..
I hydratet med den hypotetiska formeln Fe (OH)tvåNHtvåEller, vattenmolekylerna är inrymda exakt mellan de två hydroxidskikten; det vill säga de interagerar genom dipoljonkrafter med väten eller vita sfärer. Det är som om två OHFeOH-smörgåsar greppades och vatten sattes in för att gruppera dem: OHFeOH (HtvåO) OHFeOH.
Vattenmolekylerna är mycket dynamiska, vilket förhindrar att hydratpartiklarna får betydande storlekar och följaktligen bildar de ett kolloidalt eller gelatinöst fast ämne..
Grön och röd rost
I hydrater har hydroxidskikten isär vattenmolekyler; de kan dock ha andra anjoner (redan nämnda), vilket orsakar ett brett utbud av gröna rostar. På samma sätt kan de till och med "fånga" molekyler så stora som DNA eller läkemedel.
Inte bara kan Fe-joner vara närvarandetvå+, men också tro3+, produkt av inre oxidation orsakad av interkalerat syre. Det skulle synbart observeras att den gröna rost (eller oxid) börjar bli rödaktig när koncentrationen av Fe ökar.3+.
Egenskaper

Fe (OH) som visas ovantvå fälls ut i ett provrör. Att vara i rikligt med vatten, bör komplex vattenhalt dominera över den just nämnda strukturen. Observera att ytan visar en orange färg, en produkt av oxidationen av Fetvå+ till tro3+ av syret i luften; det vill säga denna hydroxid är ett reduktionsmedel:
Trotvå+ <=> Tro3+ + och-
Det fysiska utseendet på denna förening i dess rena tillstånd är ett brunt fast ämne:

Vilket, beroende på dess fuktighetsnivå, kan se ut som ett geléliknande grönt fast ämne. Det är ganska olösligt i vatten (Ksp= 8 10-16 och löslighet = 0,72 g / 100 ml vid 25 ° C) och har en molmassa av 89,86 g / mol och en densitet av 3,4 g / ml.
Inga kok- eller smältpunkter rapporteras för denna förening; troligen på grund av att det före en värmekälla torkar ut och omvandlas till järnoxid, FeO:
Fe (OH)två => FeO + HtvåELLER
Applikationer
Kvalitativ organisk analys
Dess reducerande effekt används för att bestämma närvaron av nitroföreningar, RNOtvå. Reaktionen för vilken ett positivt test erhålls representeras av följande kemiska ekvation:
RNOtvå + 6Fe (OH)två + 4HtvåO => RNHtvå + 6Fe (OH)3
Fe (OH)3 fälls ut som ett rödbrunt fast ämne, vilket intygar närvaron av nitrogruppen, -NOtvå.
Selenoxoanjonreducerare
Den reducerande effekten av Fe (OH)två den har också använts för att minska SeO-anjoner3två- (selenit) och SeO4två- (selenat) till elementärt selen, Se. Praktiskt taget möjliggör det avlägsnande av sådana anjoner som är skadliga för hälsan i form av ett olösligt och lätt extraherbart selen fast ämne.
Dubbla lager material
Dess rena struktur och den gröna rost är en inspirationskälla för design av nya material med mineralogiska egenskaper..
Det uppskattas att deras funktion är att tillåta transport av en specifik art mellan dess lager, på ett sådant sätt att dess utsläpp till det aktiva stället (jord, celler, metallyta etc.) kan kontrolleras eller minskas..
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Wikipedia. (2019). Järn (II) hydroxid. Återställd från: en.wikipedia.org
- Nationellt centrum för bioteknikinformation. (2019). Järnhydroxid. PubChem-databas. CID = 10129897. Återställd från: pubchem.ncbi.nlm.nih.gov
- Nick Doe. (s.f.). Tester för fenoler och nitrogrupper. Kemi 211. Återställd från: academics.wellesley.edu
- Clark Jim. (27 april 2019). Järnkemi. Kemi LibreTexts. Återställd från: chem.libretexts.org
- Kingston teknisk programvara. (2019). Rostkemi. Korrosionsläkare. Återställd från: corrosion-doctors.org
- Zingaro, Ralph A. et al. (1997). Reduktion av oxoselenanjoner med järn (II) hydroxid. Miljö International. 23 (3): 299-304. doi: 10.1016 / S0160-4120 (97) 00032-9



Ingen har kommenterat den här artikeln än.