
Kaliumhypoklorit (KOCl) struktur, egenskaper
De kaliumhypoklorit Det är kaliumsaltet av hypoklorsyra. Det är också ett ternärt salt av kalium, syre och klor och utgör en oorganisk förening. Dess kemiska formel är KOCl, vilket innebär att katjonen K finns i den joniska fasta substansen.+ och anjonen OCl- i ett stökiometriskt förhållande 1: 1.
Av deras homologa föreningar (LiOCl, NaOCl, Ca (OCl)två) är kanske den minst använda och populärt kända inom den kemiska och pragmatiska kulturen. Alla dessa salter har den gemensamma nämnaren för hypokloritanjonen (OCl-), vilket ger dem sina huvudsakliga egenskaper som blekmedel.
Historien om kaliumhypoklorit och dess fysikalisk-kemiska egenskaper liknar natriumhypokloritsaltet. Den producerades ursprungligen 1789 av Claude Louis Berthollet i Javel, Paris. Författarens reaktion som ledde till syntesen av nämnda förening uttrycks av följande kemiska ekvation:
Cltvå + 2KOH => KCl + KClO + HtvåELLER
Enligt ekvationen reagerar molekylärt klor med kaliumhydroxid (eller kaustiskt kaliumklorid), vilket reducerar och oxiderar kloratomerna. Detta kan verifieras genom att jämföra oxidationsantalet Cl i KCl (-1) med det för Cl i KClO (+1).
Artikelindex
- 1 Kemisk struktur
- 2 Nomenklatur
- 3 fastigheter
- 3.1 Molmassa
- 3.2 Utseende
- 3.3 Densitet
- 3.4 Smältpunkt
- 3.5 Kokpunkt
- 3.6 Löslighet i vatten
- 3.7 Reaktivitet
- 4 användningsområden
- 5 Referenser
Kemisk struktur

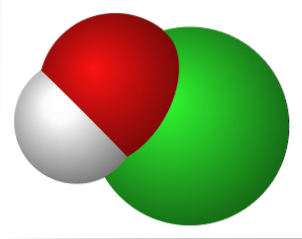
Den övre bilden representerar de elektrostatiska interaktionerna mellan katjonen K+ och anjonen OCl- (med syre som bär en negativ formell laddning).
Dessa joner har samma stökiometriska proportioner (1: 1) och deras icke-riktade krafter bildar ett kristallint arrangemang, där K+ är placerad så nära O-atomen.
Även om det inte finns några studier som beskriver kristallsystemet för KOCl (kubiskt, ortorombiskt, monokliniskt etc.) är det tillräckligt att visualisera det som en stor sfär av K+ lockas till linjär geometrijon av OCl-.
Man kan tro att till skillnad från NaOCl bildar KOCl kristaller med lägre gitterenergi, eftersom K+ är större än Na+ jämfört med OCl-. Denna större olikhet mellan deras joniska radier gör de elektrostatiska krafterna som finns mellan dem mindre effektiva..
Även prestanda i vattenlösning för detta salt kan förväntas vara liknande den för NaOCl. Omgiven av vatten, K+ -mer voluminös - den måste ha en hydreringssfär som är större än Na+. Annars skiljer sig egenskaperna hos dess lösningar (färg, lukt och blekningskraft) inte i väsentlig grad..
Nomenklatur
Varför heter kaliumhypokloritsaltet så? För att svara på detta måste man tillgripa nomenklaturen för ternära salter som styrs av IUPAC. Först och främst, eftersom kalium bara har valens +1, är det onödigt att skriva ner det; därför ignoreras det. Så skriv inte kaliumhypoklorit (I).
Klorsyra har formeln HClO3. När antalet oxygener minskar får kloratomen fler elektroner; det vill säga den har mindre positiva oxidationsnummer. I denna syra har Cl till exempel ett oxidationsnummer på +5.
Liksom i HClO har Cl ett oxidationsnummer av +1 som dessutom har två enheter mindre O-atomer (1 istället för 3 jämfört med HClO3), ändelsen av dess namn ändras till -oso. På samma sätt, eftersom +1 är det minsta oxidationsnummer som Cl-atomen kan nå, läggs prefixet -hypo till..
Så, HClO kallas hypoklorsyra. Emellertid är KOCl dess kaliumsalt och för Cl-oxidationsnummer mindre än +5 byts suffixet -oso ut mot suffixet -ito. I annat fall ändras suffixet till -ate för oxidationstal som är lika med eller större än +5. Så namnet förblir kaliumhypoklorit.
Egenskaper
Molmassa
90,55 g / mol.
Utseende
Det är en något gråaktig vätska.
Densitet
1,16 g / cm3
Smältpunkt
-2 ° C (28 ° F; 271 ° K). Denna låga smältpunkt, trots dess bindningars joniska karaktär, visar den svaga kristallina gitterenergin hos dess rena fasta ämne, en produkt av de monovalenta laddningarna av K+ och OCl-, och till skillnad från dess joniska radier.
Kokpunkt
102 ° C (216 ° F, 375 ° K). Det är bara något högre än rent vatten.
Vattenlöslighet
25% vikt / volym, detta är ett rimligt värde med tanke på att vattenmolekylerna är lätta att solvatera K-joner+.
Vattenlösningar av kaliumhypoklorit har blekningsegenskaper, liksom NaOCl. Det är irriterande och kan orsaka allvarliga skador vid kontakt med hud, ögon och slemhinnor. På samma sätt producerar inandningen bronkial irritation, andningsbesvär och lungödem..
Reaktivitet
-Kaliumhypoklorit är ett kraftfullt oxidationsmedel som inte anses vara ett element som orsakar bränder eller explosioner. Det kan dock kombineras med olika kemiska element för att producera brandfarliga och explosiva föreningar..
-I kontakt med urea kan det bilda NCl3, en mycket explosiv förening. Vid uppvärmning eller kontakt med syror producerar det mycket giftig kloridrök. Reagerar kraftigt med kol i en potentiellt explosiv reaktion.
-Det kombineras med acetylen för att bilda den explosiva kloracetylen. På samma sätt kan dess reaktion med organiskt material, olja, kolväten och alkoholer orsaka explosioner. Dess reaktion med nitrometan, metanol och etanol kan bli explosiv.
-Det sönderdelar frigörande syre, en process som kan katalyseras av rost eller av metallbehållaren som innehåller den..
-Kaliumhypoklorit måste förvaras kallt för att undvika bildning av kaliumklorat, vars sönderdelning till och med kan vara explosiv..
Applikationer
-Används som en desinfektionsmedel för yt- och dricksvatten.
-Nedbrytningen i jordar av kaliumhypoklorit till kaliumklorid har föreslagit att den ska användas i grödor som kaliumkälla, ett primärt näringsämne för växter..
-Vissa företag har föreslagit att den ska användas som en ersättning för NaOCl som blekmedel och hävdar de fördelaktiga egenskaperna hos K ion+ mot miljöpåverkan orsakad av Na+.
Referenser
- Enviro Tech. Den natriumfria lösningen. [PDF]. Hämtad den 29 maj 2018 från: envirotech.com
- PubChem. (2018). Kaliumhypoklorit. Hämtad den 29 maj 2018 från: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Kaliumhypoklorit. Hämtad den 29 maj 2018 från: en.wikipedia.org
- Kemikaliebok. (2017). Kaliumhypoklorit. Hämtad den 29 maj 2018 från: chemicalbook.com
- Whitten, Davis, Peck & Stanley. Kemi. (8: e upplagan). CENGAGE Learning, s 873, 874.



Ingen har kommenterat den här artikeln än.