
Histonens egenskaper, struktur, typer och funktioner
De histoner är basiska proteiner som interagerar med DNA för bildandet av nukleosomer, som utgör kromatinsträngarna som utgör kromosomer i eukaryota organismer.
Nukleosomer, komplex som består av DNA och proteiner, upptäcktes 1974 och det är histoner som samlar denna basala nivå av kromatinorganisation. Förekomsten av histonproteiner har dock varit känd sedan före 1960-talet..
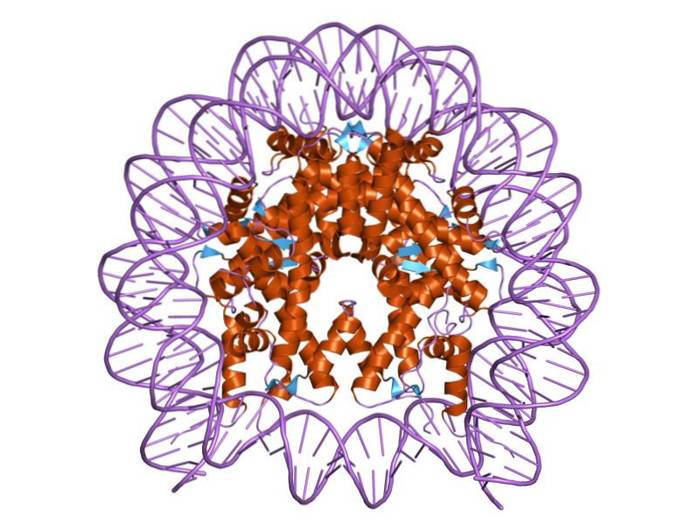
Histoner är organiserade på ett sådant sätt att dubbelband-DNA lindas runt ett proteincenter som består av dessa proteiner som interagerar nära varandra. Histonkärnan är formad som en skiva, och DNA går runt 1,7 gånger runt den..
Flera vätebindningar tillåter DNA att binda till proteincentret som bildas av histonerna i varje nukleosom. Dessa bindningar bildas för det mesta mellan aminosyran i histonerna och sockerfosfat-ryggraden i DNA. Vissa hydrofoba interaktioner och jonbindningar deltar också.
Proteiner som kallas "kromatin-remodeling complexes" är ansvariga för nedbrytningen och bildningen av förbindningsbindningarna mellan DNA och histoner, vilket möjliggör inträde av transkriptionsmaskineriet i DNA som finns i nukleosomerna.
Trots närheten av nukleinsyror till proteincentret som bildas av histoner, är dessa ordnade på ett sådant sätt att de vid behov tillåter inmatning av transkriptionsfaktorer och andra proteiner relaterade till genuttryck eller genavstängning..
Histoner kan genomgå olika modifieringar som genererar flera varianter, vilket möjliggör förekomsten av många olika former av kromatin som har egenskapen att modulera genetiskt uttryck på olika sätt..
Artikelindex
- 1 Funktioner
- 2 Struktur
- 2.1 Bindande histoner
- 3 typer
- 3.1 Nukleosomala histoner
- 3.2 Bindande histoner
- 4 funktioner
- 5 Referenser
Egenskaper
De är ett av de mest konserverade eukaryota proteinerna i naturen. Till exempel har ärthiston H4 visat sig skilja sig i bara två av de 102 aminosyrapositionerna hos ko-H4-proteinet..
Histoner är relativt små proteiner, med högst 140 aminosyror. De är rika på basiska aminosyrarester, så de har en nettoladdning, vilket bidrar till deras interaktion med den negativt laddade nukleinsyran för att bilda nukleosomer..
Nukleosomala och överbryggande histoner är kända. De nukleosomala histonerna är H3, H4, H2A och H2B, medan de bindande histonerna tillhör familjen av histoner Hl.
Under nukleosommontering bildas initialt specifika dimerer H3-H4 och H2A-H2B. Två H3-H4-dimerer sammanfogas sedan för att bilda tetramerer som senare kombineras med H2A-H2B-dimerer och bildar det oktameriska centrumet..
Alla histoner syntetiseras huvudsakligen under S-fasen i cellcykeln, och nukleosomer samlas i de framväxande DNA-spiralerna, precis efter replikationsgaffeln..
Strukturera
Den allmänna strukturen för histoner inkluderar en basisk aminosyraregion och en globulär karboxylregion som är mycket konserverad bland eukaryota organismer..
Ett strukturellt motiv som kallas "histonveck", som består av tre alfa-helixer som är förbundna med två hårnålar och bildar ett litet hydrofobt centrum, är ansvarig för protein-protein-interaktioner mellan histonerna som utgör nukleosomen..
Det är denna vikning av histoner som utgör den globulära karboxyldomänen för dessa nukleosomala proteiner i alla eukaryoter..
Histoner har också små "svansar" eller aminoterminala och andra karboxylterminala regioner (tillgängliga för proteaser), högst 40 aminosyror långa. Båda regionerna är rika på basiska aminosyror som kan genomgå flera kovalenta modifieringar efter translation..
Bindande histoner
I eukaryoter finns två familjer av bindande histoner, som skiljer sig från varandra genom sin struktur. Vissa har en trepartsstruktur, med den globulära domän som beskrivs ovan flankeras av "ostrukturerade" N- och C-terminala domäner; medan andra bara har en C-terminal domän.
Även om de flesta histoner är konserverade kan specifika varianter uppstå under embryogenes eller mognad av specialiserade celler i vissa organismer. Vissa strukturella variationer har att göra med modifieringar efter translation, såsom följande:
-Fosforylering: det anses vara relaterat till modifieringen av kondensationsgraden av kromatin och det förekommer vanligtvis i serinrester.
-Acetylering: associerad med kromosomala regioner som är transkriptionellt aktiva. Det förekommer normalt på sidokedjorna av lysinrester. När de förekommer på dessa rester minskar deras positiva laddning och därigenom minskar proteins affinitet för DNA..
-Metylering: kan förekomma som mono-, di- eller trimetylering av lysinrester som sticker ut från proteinkärnan.
Specifika enzymer är ansvariga för dessa kovalenta modifieringar i histoner. Dessa enzymer inkluderar histon-acetyltransferaser (HAT), histondeacetylaskomplex (HDAC) och histon-metyltransferaser och demetylaser..
Typer
Karaktäriseringen av histonerna har utförts med olika biokemiska tekniker, bland vilka kromatografierna som är baserade på svaga katjonbytarhartser sticker ut..
Vissa författare upprättar en klassificering där 5 huvudtyper av histoner urskiljs i eukaryoter: FI, med 21 kDa proteiner; F2A1 eller FIV, plus eller minus 11,3 kDa; F2A2 eller FIIbI, 14,5 kDa; F2B eller FIIb2, med en molekylvikt av 13,7 kDa, och F3 eller FIII, av 15,3 kDa.
Alla dessa typer av histoner, med undantag av IF-gruppen, finns i ekvimolära mängder i celler..
En annan klassificering, med samma giltighet och kanske den mest använda idag, föreslår att det finns två olika typer av histoner, nämligen: de som ingår i nukleosomens oktamer och bindnings- eller överbryggande histoner, som sammanfogar nukleosomerna mellan Ja.
Vissa varianter kan också förekomma mellan arter och till skillnad från kärnhistoner syntetiseras varianter under interfas och införs i det förformade kromatinet genom en process som är beroende av den energi som frigörs från ATP-hydrolys..
Nukleosomala histoner
Centrumet för en nukleosom består av ett par av var och en av de fyra ingående histonerna: H2a, H2b, H3 och H4; på vilka DNA-segment av cirka 145 baspar är lindade.
Histonerna H4 och H2B är i princip oföränderliga. Vissa variationer är dock uppenbara i histonerna H3 och H2A, vars biofysiska och biokemiska egenskaper förändrar nukleosomens normala natur..
En variant av histon H2A hos människor, H2A.Z-proteinet har en stor sur region och kan främja nukleosomstabilitet beroende på histon H3-varianter som det är associerat med..
Dessa histoner visar viss variation mellan arter, ett speciellt fall är det för histon H2B, för vilken den första tredjedelen av molekylen är mycket variabel..
Bindande histoner
De bindande eller överbryggande histonerna är klass H1-histoner. Dessa är ansvariga för föreningen mellan nukleosomer och skyddet av DNA som sticker ut i början och i slutet av varje partikel..
Till skillnad från nukleosomala histoner, har inte alla histon av H1-typ den globulära regionen av "vikningen" av histon. Dessa proteiner binder till DNA mellan nukleosomer, vilket underlättar en förskjutning i kromatinbalansen mot ett mer kondenserat och mindre aktivt tillstånd, transkriptionellt sett..
Studier har kopplat dessa histoner till åldrande, DNA-reparation och apoptotiska processer, varför de anses spela en avgörande roll för att upprätthålla genomisk integritet.
Funktioner
Alla aminosyrarester av histoner deltar, på ett eller annat sätt, i deras interaktion med DNA, vilket förklarar det faktum att de är så konserverade bland kungariken i eukaryota organismer..
Deltagande av histoner i förpackningen av DNA i form av kromatin är av stor betydelse för komplexa flercelliga organismer där de olika cellinjerna endast kan specialisera sig genom att ändra tillgängligheten för deras gener till transkriptionsmaskineriet..
Transkriptionellt aktiva genomregioner är täta i nukleosomer, vilket antyder att kopplingen av DNA med histonproteiner är avgörande för den negativa eller positiva regleringen av deras transkription..
På samma sätt beror svaret på ett stort antal stimuli, både inre och yttre, under hela cellens liv på små förändringar i kromatin, som normalt har att göra med ombyggnad och post-translationell modifiering av histonerna som finns i nära samband med DNA.
Flera histonvariabler tjänar olika funktioner i eukaryoter. En av dem har att göra med deltagandet av en variant av histon H3 i bildandet av de centromera strukturerna som är ansvariga för segregeringen av kromosomer under mitos..
Motsatsen till detta protein i andra eukaryoter har visat sig vara väsentlig för sammansättningen av proteinkinetokoren till vilken spindelmikrotubuli binder under mitos och meios..
Referenser
- Alberts, B., Johnson, A., Lewis, J., Morgan, D., Raff, M., Roberts, K., & Walter, P. (2015). Molecular Biology of the Cell (6: e upplagan). New York: Garland Science.
- Campos, E. I., & Reinberg, D. (2009). Histoner: Annoteringskromatin. Annu. Pastor Genet., 43, 559-599.
- Harvey, A. C., & Downs, J. A. (2004). Vilka funktioner tillhandahåller länkhistoner? Molekylär mikrobiologi, 53, 771-775.
- Henikoff, S., och Ahmad, K. (2005). Montering av varianthistoner i kromatin. Annu. Pastor Cell. Dev. Biol., tjugoett, 133-153.
- Isenberg, I. (1979). Histoner. Annu. Pastor Biochem., 48, 159-191.
- Kornberg, R. D., & Thomas, J. O. (1974). Kromatinstruktur: Oligomerer av histonerna. Vetenskap, 184(4139), 865-868.
- Smith, E., DeLange, R., & Bonner, J. (1970). Histonens kemi och biologi. Fysiologiska recensioner, femtio(2), 159-170.



Ingen har kommenterat den här artikeln än.