
Topp 6 faktorer som påverkar lösligheten
Main faktorer som påverkar lösligheten De är polaritet, gemensam joneffekt, temperatur, tryck, lösningens natur och mekaniska faktorer. Löslighet är förmågan hos en fast, flytande eller gasformig kemikalie (kallad löst ämne) att lösa sig i ett lösningsmedel (vanligtvis en vätska) och bilda en lösning..
Ett ämnets löslighet beror huvudsakligen på det använda lösningsmedlet, samt på temperatur och tryck. Lösligheten för ett ämne i ett visst lösningsmedel mäts genom koncentrationen av den mättade lösningen.

En lösning anses vara mättad när tillsatsen av ytterligare lösningsmedel inte längre ökar koncentrationen av lösningen..
Graden av löslighet varierar mycket beroende på ämnena, från oändligt lösliga (helt blandbara), såsom etanol i vatten, till lätt lösliga, såsom silverklorid i vatten. Termen "olöslig" används ofta på dåligt lösliga föreningar (Boundless, S.F.).
Vissa ämnen är lösliga i alla proportioner med ett givet lösningsmedel, såsom etanol i vatten, denna egenskap är känd som blandbarhet.
Under olika förhållanden kan jämviktslösligheten överskridas för att ge en så kallad övermättad lösning (Löslighet, S.F.).
Viktiga faktorer som påverkar lösligheten
1- Polaritet
I de flesta fall löses upplösta ämnen i lösningsmedel som har liknande polaritet. Kemister använder en populär aforism för att beskriva denna egenskap hos lösta ämnen och lösningsmedel: "som löser upp som".
Icke-polära lösta ämnen löses inte upp i polära lösningsmedel och vice versa (Utbildning online, S.F.).
2- Effekt av den gemensamma jonen
Den vanliga joneffekten är en term som beskriver minskningen av en jonföreningars löslighet när ett salt som innehåller en jon som redan finns i kemisk jämvikt tillsätts till blandningen..
Denna effekt förklaras bäst av Le Châteliers princip. Föreställ dig om den lättlösliga jonföreningen kalciumsulfat, CaSO4, tillsätts till vattnet. Den nettojoniska ekvationen för den resulterande kemiska jämvikten är som följer:
CaSO4 (s) ⇌Ca2 + (aq) + SO42− (aq)
Kalciumsulfat är något lösligt. Vid jämvikt finns det mesta av kalcium och sulfat i fast form av kalciumsulfat..
Antag att den lösliga joniska föreningen kopparsulfat (CuSO4) tillsattes till lösningen. Kopparsulfat är lösligt; Därför är dess enda huvudsakliga effekt på den nettojoniska ekvationen tillsatsen av fler sulfatjoner (SO4två-).
CuSO4 (s) ⇌Cu2 + (aq) + SO42− (aq)
Sulfatjoner dissocierade från kopparsulfat är redan närvarande (gemensamma för) i blandningen från lätt dissociation av kalciumsulfat.
Därför betonar denna tillsats av sulfatjoner den tidigare etablerade jämvikten.
Le Chateliers princip dikterar att den ytterligare spänningen på denna sida av jämviktsprodukten resulterar i jämviktsförskjutningen mot reaktantsidan för att lindra denna nya spänning..
På grund av förskjutningen mot reaktantsidan minskar lösligheten för något lösligt kalciumsulfat ytterligare (Erica Tran, 2016).
3- Temperatur
Temperatur har en direkt effekt på lösligheten. För de flesta joniska fasta ämnen ökar temperaturökningen hur snabbt lösningen kan göras.
När temperaturen ökar rör sig partiklarna i det fasta ämnet snabbare, vilket ökar chanserna att de kommer att interagera med fler partiklar av lösningsmedlet. Detta resulterar i en ökning av hastigheten med vilken en lösning produceras..
Temperaturen kan också öka mängden löst ämne som kan lösas i ett lösningsmedel. Generellt sett, när temperaturen ökar, upplöses fler lösta partiklar.
Till exempel är tillsats av bordssocker till vatten en enkel metod för att göra en lösning. När lösningen värms upp och socker tillsätts, har man funnit att stora mängder socker kan tillsättas när temperaturen fortsätter att öka..
Anledningen till detta är att när temperaturen ökar kan de intermolekylära krafterna brytas lättare, vilket gör att mer lösta partiklar kan lockas till lösningsmedelspartiklarna..
Det finns dock andra exempel där temperaturökning har mycket liten effekt på hur mycket löst ämne som kan lösas..
Bordsalt är ett bra exempel: du kan lösa upp nästan samma mängd bordssalt i isvatten som du kan i kokande vatten..
När temperaturen ökar minskar lösligheten för alla gaser. Kinetisk molekylär teori kan användas för att förklara detta fenomen..
När temperaturen ökar rör sig gasmolekylerna snabbare och kan fly från vätskan. Gasens löslighet minskar då.
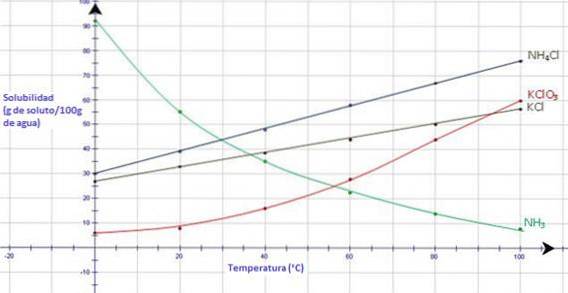
Med tanke på diagrammet nedan visar ammoniakgas, NH3, en kraftig minskning av lösligheten när temperaturen ökar, medan alla joniska fasta ämnen visar en ökning av lösligheten när temperaturen ökar (CK-12 Foundation, S.F.).
4- Tryck
Den andra faktorn, trycket, påverkar lösligheten av en gas i en vätska men aldrig av ett fast ämne som löser sig i en vätska..
När ett tryck appliceras på en gas som ligger ovanför ytan på ett lösningsmedel kommer gasen att röra sig in i lösningsmedlet och uppta några av utrymmena mellan lösningsmedelspartiklarna..
Ett bra exempel är kolsyrad läsk. Tryck appliceras för att tvinga CO2-molekylerna in i läsket. Motsatsen är också sant. När gasens tryck minskar minskar också gasens löslighet.
När en läskburk öppnas sjunker trycket i sodan så att gasen omedelbart börjar komma ur lösningen.
Koldioxid som lagras i läsket släpps ut och du kan se bruset på vätskans yta. Om du lämnar en öppen burk läsk under en tidsperiod kanske du märker att drycken blir platt på grund av förlusten av koldioxid.
Denna gastrycksfaktor uttrycks i Henrys lag. Henrys lag säger att, vid en given temperatur, är en gas löslighet i en vätska proportionell mot gasens partiella tryck över vätskan.
Ett exempel på Henrys lag förekommer vid dykning. När en person dyker ner på djupt vatten ökar trycket och fler gaser löses upp i blodet.
När dykaren stiger från ett djupt vattendyk måste dykaren återvända till vattenytan med mycket långsam hastighet så att alla upplösta gaser lämnar blodet mycket långsamt.
Om en person går upp för snabbt kan en medicinsk nödsituation uppstå på grund av att gaser lämnar blodet för snabbt (Papapodcasts, 2010).
5- Lösningens art
Löslighetens och lösningsmedlets natur och närvaron av andra kemiska föreningar i lösningen påverkar lösligheten..
Till exempel kan mer socker lösas i vatten än salt i vatten. I detta fall sägs det att socker är mer lösligt.
Etanol i vatten är helt lösliga med varandra. I detta speciella fall kommer lösningsmedlet att vara den förening som finns i den största mängden.
Lösningens storlek är också en viktig faktor. Ju större de upplösta molekylerna, desto större är dess molekylvikt och storlek. Det är svårare för lösningsmedelsmolekyler att omge större molekyler.
Om alla ovan nämnda faktorer utesluts kan en allmän tumregel konstateras att större partiklar i allmänhet är mindre lösliga..
Om trycket och temperaturen är samma som mellan två lösta ämnen med samma polaritet är den med mindre partiklar vanligtvis mer löslig (Faktorer som påverkar löslighet, S.F.).
6- mekaniska faktorer
I motsats till upplösningshastigheten, som huvudsakligen beror på temperaturen, beror omkristallisationshastigheten på den lösta koncentrationen på ytan av kristallgitteret, vilket föredras när en lösning är orörlig.
Omröring av lösningen förhindrar därför denna ansamling, vilket maximerar upplösningen. (mättnadsslangar, 2014).
Referenser
- (S.F.). Löslighet. Återställd från boundles.com.
- CK-12 Foundation. (S.F.). Faktorer som påverkar lösligheten. Återställd från ck12.org.
- Utbildning online. (S.F.). Faktorer som påverkar lösligheten. Återställd från solubilityofthings.com.
- Erica Tran, D. L. (2016, 28 november). Löslighet och faktorer som påverkar löslighet. Återställd från chem.libretexts.org.
- Faktorer som påverkar lösligheten. (S.F.). Återställd från sciencesource.pearsoncanada.ca.
- (2010, 1 mars). Faktorer som påverkar lösligheten del 4. Återställd från youtube.com.
- Löslighet. (S.F.). Återställd från chemed.chem.purdue.ed.
- mättnadstoppar. (2014, 26 juni). Återställd från kemi libretex.org.


Ingen har kommenterat den här artikeln än.