
Medium MIO-grund, beredning och användningsområden
De halv MIO är ett biokemiskt test som används för att identifiera bakteriearter som tillhör Enterobacteriaceae-familjen. Det är ganska näringsrikt och består av glukos, jästextrakt, pepton, triptein, L-ornitinhydroklorid, bromokresollila och agar.
Betydelsen av dess akronym (MIO) beskriver var och en av de parametrar som kan observeras i detta medium; rörlighet, indol och ornitin. Motilitet är mikroorganismens förmåga att röra sig på grund av förekomsten av flageller. För att denna egenskap ska observeras måste mediumets konsistens vara halvfast, så beredningen innehåller mindre agar..
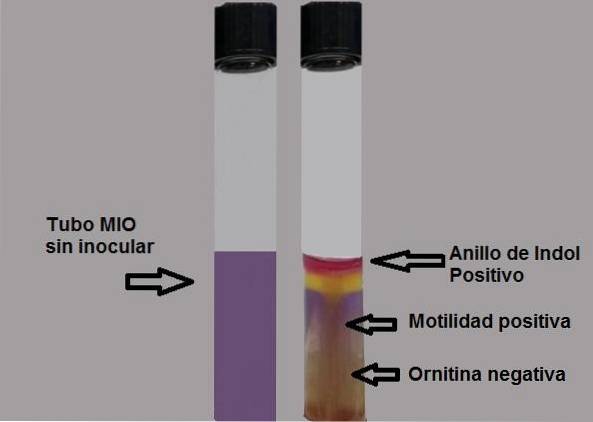
Framställningen av indol visar närvaron av enzymet tryptofanas som verkar på aminosyran tryptofan, vilket kräver användning av ett avslöjande reagens för att göra produktionen av indol synlig..
Slutligen bestämmer ornitin om bakterien kan dekarboxylera aminosyran, det vill säga om den har enzymet orinitindekarboxylas.
Artikelindex
- 1 Motivering
- 1.1 Pepton, jästextrakt och triptein
- 1.2 Rörlighet
- 1.3 Glukos
- 1,4 L-ornitin
- 1,5 pH-indikator
- 2 Sådd och utvecklingsteknik
- 3 Förberedelse
- 3.1 MIO-medium
- 3.2 Kovacs Reagent (Indole Test Developer)
- 4 Använd
- 5 Kvalitetskontroll
- 6 Referenser
Grund
Pepton, jästextrakt och triptein
Dessa element bidrar till näringskraften hos detta medium. De fungerar som en källa till näringsämnen och essentiella aminosyror för bakteriell utveckling.
Dessutom är triptein en källa till tryptofan för att visa närvaron av enzymet tryptofanas, som bryter ned tryptofan genom reduktiv deaminering, vilket frigör indol, pyruvsyra, ammoniak och energi..
Indol är färglös, därför avslöjas dess närvaro genom att tillsätta fem droppar Ehrlichs eller Kovacs reagens, båda med p-dimetylaminobensaldehyd..
Aldehydgruppen i denna förening reagerar med indol och genererar en ringformad, fuchsia-röd produkt på ytan av agaren..
Varje färgspår bör betraktas som ett positivt test. Beviset bör läsas omedelbart, eftersom färgen försämras med tiden.
Dessutom bör detta test avslöjas efter att ornitinens rörlighet och dekarboxyleringsresultat har noterats..
Tolkning
Positivt test: bildning av en fuchsia-röd ring vid tillsats av droppar av Kovacs reagens.
Negativt test: ingen ringbildning.
Rörlighet
Bakteriens förmåga att röra sig kommer att bevisas om ett grumligt medium observeras eller om det finns en tjock tillväxtlinje som expanderar runt den initiala inokuleringen..
Ett negativt rörlighetstest bevisas genom att observera en tunn tillväxtlinje, och allt runt det kommer att vara utan tillväxt..
Det är viktigt att rörligheten avläses innan indolen avslöjas, eftersom tillsatsen av reagenset fördunklar hela mediet..
I mobila men långsamt växande bakterier är det svårt att visa sin rörlighet med detta medium. I det här fallet rekommenderas det att använda andra tester eller metoder, såsom medelrörlighet eller drop-pending-metod..
Glukos
Glukos är det fermenterbara kolhydraten som, förutom att ge energi, försurar miljön, ett nödvändigt villkor för att dekarboxyleringen av aminosyran ornitin ska ske..
Glukosjäsning måste alltid förekomma, med utgångspunkt från principen att alla bakterier som tillhör Enterobacteriaceae-familjen jäser glukos..
L-Ornitin
I händelse av att bakterierna producerar enzymet ornitindekarboxylas kan detta verka när mediet har surgjorts genom fermentering av glukos..
Enzymet ornitindekarboxylas verkar på karboxylgruppen i aminosyran som producerar en amin som kallas putresin som alkaliserar mediet igen.
Detta test bör läsas efter 24 timmars inkubation, för om du försöker läsa innan kan du tolka testet felaktigt med falskt negativt.
Man måste komma ihåg att den första reaktionen som sker är jäsning av glukos, varför mediet blir gult i en inledande fas (första 10 till 12 timmar). Om ornitindekarboxylering därefter inträffar blir mediet lila.
Det är viktigt att tolka ornitindekarboxyleringstestet innan indol avslöjas, eftersom tillsatsen av Kovacs reagens modifierar mediets färg..
Tolkning
Negativt test: gul medium eller gul bakgrund.
Positivt test: hälften helt lila.
PH-indikator
I detta fall används bromokresollila; den som ansvarar för att avslöja när det finns en förändring i pH i mediet. När den är sur, blir indikatorn gul och när den är alkalisk blir den lila.
Sådd och utvecklingsteknik
För att så MIO-mediet används en rak slinga eller nål och med den samlas en del av kolonin som ska studeras..
En djup punktering görs mitt i MIO i en rak linje. Det är inte tillrådligt att utföra en dubbel punktering, eftersom det kan ge en falsk bild av rörlighet om punkteringarna inte utförs på samma plats.
Inkubera i 24 till 48 timmar vid 37 ° C i aerobios. Observera resultaten i denna ordning: rörlighet, dekarboxylering av ornitinet och avslöja slutligen indolen.
Det rekommenderas att aseptiskt ta bort 2 ml av mediet, överföra det till ett sterilt rör och utföra indoltestet där, så att om det är negativt kan resten av originalröret inkuberas i ytterligare 24 timmar för att avslöja indol igen..
Utvecklingen av indolen utförs enligt följande: 3 till 5 droppar Kovacs reagens tillsätts till MIO-mediet och det skakas kraftigt. Det observeras om en röd fuchsia-ring dyker upp eller inte.
Förberedelse
Medium MIO
Väg upp 31 g av MIO-mediet och lös upp det i en liter destillerat vatten..
Värm tills blandningen kokar i en minut, skakar ofta tills agaren är helt upplöst. Fördela 4 ml av mediet i 13/100 provrör med bomullslock.
Sterilisera i autoklav vid 121 ° C i 15 minuter. Ta bort från autoklaven och låt stå rakt i ett rack, så att ett halvfast block bildas.
Förvara i kylskåp 2-8 ° C. Låt det värmas innan bakteriestammen sås.
Färgen på det uttorkade mediet är beige och färgen på det beredda mediet något opaliserande lila..
Det slutliga pH-värdet för det beredda mediet är 6,5 ± 0,2
Mediet blir gult vid surt pH och är lila vid alkaliskt pH.
Kovacs Reagent (Indole Test Developer)
Detta reagens framställs enligt följande:
150 ml amyl, isoamyl eller butylalkohol (vilken som helst av de tre) mäts. 10 g p-dimetylaminobensaldehyd löses i den. Därefter tillsättes långsamt 50 ml koncentrerad saltsyra..
Det beredda reagenset är färglöst eller ljusgult. Den ska förvaras i en gul flaska och förvaras i kylskåp. En mörkbrun färg visar dess försämring.
Kovacs-reagenset kan också ersätta Ehrlich-reagenset. Den senare, eftersom den är mer känslig, föredras att avslöja indol i bakterier som producerar den i små mängder, såsom i vissa icke-jäsande gramnegativa stavar och vissa anaerober..
Använda sig av
Detta medium är ett test som kompletterar ett batteri av biokemiska tester för identifiering av bakterier som tillhör Enterobacteriaceae-familjen..
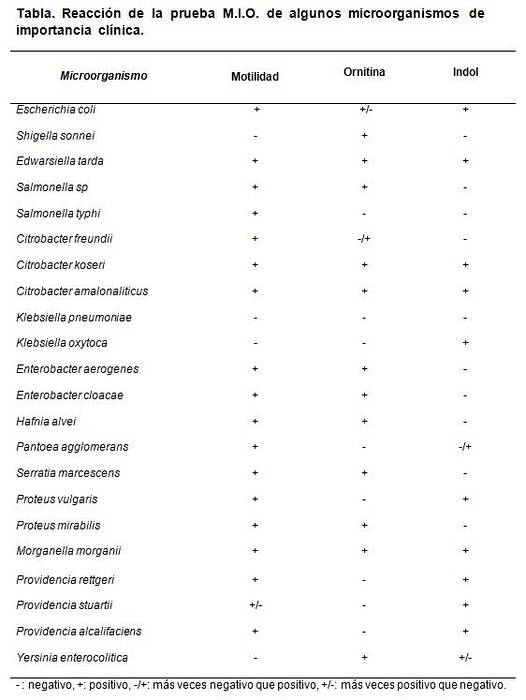
Data för dekarboxylering av ornitin tjänar till att skilja mellan Shigella sonnei, som ger positivt, av Shigella boydii, Shigella flexneri och S. dysenterieae, som ger negativa.
Det skiljer också släktet Klebsiella, som testar negativt, från släktet Enterobacter, där de flesta av dess arter testar positivt..
QA
Varje gång en sats MIO-medium bereds kan ett kontrolltest utföras. För detta används kända eller certifierade stammar för att observera mediet..
De stammar som kan användas är Escherichia coli, Morganella morganii, Klebsiella pneumoniae, Enterobacter aerogenes Y Proteus mirabilis.
De förväntade resultaten är E. coli och M. morganii. Dan M: +, I: + och O: +.
Klebsiella pneumoniae ger alla negativa (M: -, I: -, O :-). Proteus mirabilis Y Enterobacter aerogenes ge M: + I: - och O: +.
Referenser
- Mac Faddin J. (2003). Biokemiska tester för identifiering av bakterier av klinisk betydelse. 3: e upplagan Ledare Panamericana. Buenos Aires. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Bailey & Scott mikrobiologisk diagnos. 12 utgåva Redaktionellt Panamericana S.A. Argentina.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologisk diagnos. 5: e upplagan Redaktionellt Panamericana S.A. Argentina.
- Britannia Laboratories. MIO Medio 2015. Tillgänglig på: britanialab.com
- BD Laboratories. BBL Motility Indole Ornithine (MIO) Medium. 2007. Tillgänglig på: bd.com
- Valtek Laboratories. Medium M.I.O. Motilitet, indol, ornitin. 2010. Tillgänglig på: andinamedica.com



Ingen har kommenterat den här artikeln än.