
Myosinegenskaper, struktur, typer och funktion
De myosin det är en molekylär motor, protein till sin natur, som kan röra sig på aktinfilament i cytosolen. Energin som driver förskjutningen av myosin kommer från hydrolysen av ATP. På grund av detta definieras myosin ofta som ett mekanokemiskt enzym.
I eukaryoter är myosin ett mycket rikligt protein. Det finns olika klasser av myosin, som kodas av en familj av gener. I jäst särskiljs 5 klasser, medan i däggdjur har dussintals beskrivits.
Myosin har en mängd olika funktioner. Myosin I deltar tillsammans med aktin i rörelsen av keratocyter.
Myosin II ger plasmamembranets styvhet, deltar i cytokinese och muskelsammandragning. Båda myosinerna I och II samarbetar med cellmigrering. Myosiner I och V utför vesikeltransport längs aktinfilament.
Artikelindex
- 1 Struktur
- 2 funktioner
- 3 funktioner
- 3.1 Muskelsammandragning
- 3.2 Cytokines
- 3.3 Styvning av kortikala membran
- 3.4 Cellvidhäftning
- 3.5 Förskjutning av vissa blåsor
- 4 Sjukdomar relaterade till myosin
- 4.1 Myosiner och hörselnedsättning
- 4.2 Myosin X och cancer
- 5 Referenser
Strukturera
I elektronmikrofotografier har den typiska strukturen hos myosinisoformer tre domäner: huvud, nacke och svans. Genom hydrolys med chymotrypsin erhålls ett segment som består av huvud och nacke, kallat tungt meromyosin (HMM), och ett segment av svansen, kallat lätt meromyosin (LMM).
Huvuddomänen är den N-terminala änden av den tunga kedjan, och svansdomänen är den C-terminala änden av den lätta kedjan.
Klasserna av myosin kan differentieras med antalet polypeptidkedjor som utgör det, och överflödet och klassen av lätt kedja fäst vid halsen.
Myosin I har en polypeptidkedja som bildar ett huvud och svansen saknar alfa-spiralformade områden. Medan myosinerna I och V har två polypeptidkedjor, bildar de därför två huvuden och en svans, i vilken de spiralformade alfakedjorna lindas för att bilda en stavliknande struktur.
Myosiner I och V har bindningsställen för kalmodulin, som reglerar och binder Ca+två, på lätta kedjor. Myosin I fixar Ca+två i lätta kedjor, men gör det annorlunda än kalmodulin.
Egenskaper
På mekanokemisk nivå har myosiner tre egenskaper, nämligen:
- Myosinhuvudet är den motoriska domänen som går framåt i diskreta steg: Myosinhuvudets sammanslutning till ett aktinfilament, dess lutning och efterföljande separering ger myosinens rörelse. Denna process är cyklisk och beror på ATP.
- Konformala förändringar: hydrolysen av en ATP-molekyl är kopplad till varje steg i en myosinmolekyl genom nivåer av amplifiering och transmission. Detta innebär stora konformationsförändringar av myosin..
Den första amplifieringsnivån produceras genom förlusten av gamma-fosfatgruppen i ATP, vilket möjliggör en omorganisation av strukturelementen i ATP-bindningsstället. Denna omorganisation koordineras med strukturella förändringar i det aktinbindande stället..
Den andra amplifieringsnivån involverar kommunikationen av konformationsförändringen i det aktiva stället till strukturella komponenter i karboxylterminalen..
- Riktning: Myosiner har visat sig ha polaritet, eller omvänd riktning, mot (+) änden av aktinfilamentet. Denna slutsats kommer från aktinfilamentslipsexperimenten med fluorescensljusmikroskop..
Funktioner
Myosin, tillsammans med aktin, deltar i muskelkontraktion, cellvidhäftning, cytokinese, förstyvning av kortikala membran och förskjutning av vissa vesiklar, bland andra funktioner..
Defekter i myosin kan ge patologiska tillstånd. Till exempel är defekter i myosinerna I och V relaterade till myosinmyopatier och pigmentstörningar (Griscellis syndrom). Medan störningar i myosin VI isoformer orsakar hörselnedsättning.
Muskelsammandragning
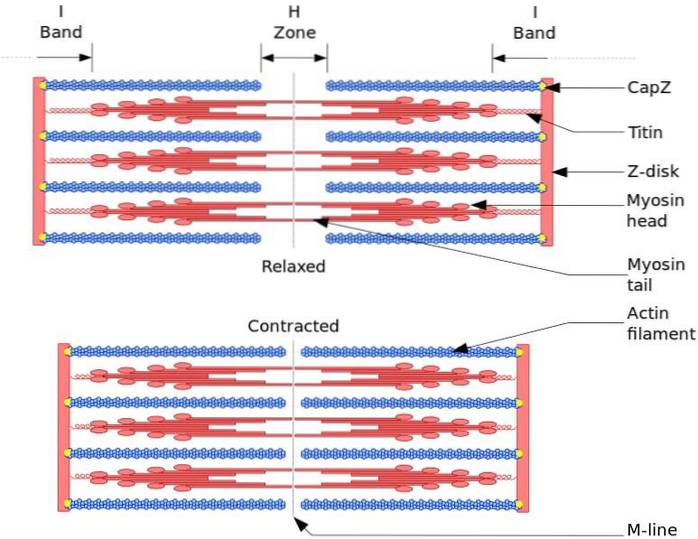
Den funktionella och strukturella enheten i skelettmuskulaturen är sarkomeren. Under muskelsammandragning når längden på sarkomeren 30% av sin ursprungliga längd.
Sarkomerer består av tjocka myosinfilament och tunna aktinfilament som är organiserade på ett komplext sätt. I allmänhet ligger myosinhuvudena vid glödtrådens distala ändar och deras svansar mot mitten av sarkomeren, och organisationen är bipolär.
För att muskelsammandragning ska inträffa måste myosinhuvudena i motsatta ändar röra sig mot Z-skivan eller (+) änden av glödtråden. Eftersom organisationen av de tjocka filamenten är bipolär sker glidningen av de tunna filamenten på de tjocka filamenten, driven av ATP.
Förskjutningskraften uppstår på grund av att hundratals myosinhuvuden, av ett tjockt filament, samverkar med ett tunt filament.
Cytokines
Under mitos, när mikrotubuli vid spindelstolparna separerar, bildar actin och myosin II en sammandragningsring vid cellens ekvatorn. Denna ring dras samman, minskar dess diameter och delar upp cellen i två delar..
Förstyvning av kortikala membran
I mutanta celler som saknar myosin II deformeras plasmamembranet lätt när en extern kraft appliceras. Detta händer eftersom myosin II ger aggregeringskraft till plasmamembranproteiner..
Cellvidhäftning
I epitelvävnad ligger de sammandragna buntarna av aktin och myosin II i närheten av plasmamembranet och bildar en cirkulär bälte som omger den inre cellytan. Denna cirkulära bälte bestämmer cellens form och bibehåller bindningen mellan cellerna..
Kontakten mellan celler sker genom förening av det cirkulära bältet till de cellulära vidhäftningsmolekylerna med hjälp av fackproteiner.
Förskjutning av vissa blåsor
Experimentellt bevis avslöjar att myosin V utför membrantransport från Golgi-apparaten till cellens periferi. Några bevis är:
- I nervvävnadsceller, genom astrocytimmunfluorescens, konstaterades att myosin V är beläget intill Golgi.
- I jäst stör mutationer i myosin V-genen utsöndringen av protein och följaktligen ackumuleras protein i cytosolen.
- Myosin I-isoformerna är ansvariga för transporten av vakuoler mot cellmembranet. Med användning av specifika antikroppar mot myosin I-isoformer, fann man att dessa isoformer finns i olika delar av cellen..
När exempelvis en levande amoeba är märkt med en antikropp mot myosin IC stoppas transporten av vakuolen till membranet. På grund av detta expanderar vakuolen och cellen spricker.
Myosinrelaterade sjukdomar
Myosiner och hörselnedsättning
Det finns många gener och mutationer som orsakar hörselnedsättning. Denna sjukdom är ofta monogenetisk .
Okonventionella myosinmutationer, med ett eller två myosinhuvuden, påverkar det inre örat. Några av de muterade myosinisoformerna är myosin IIIA, myosin VIIA och myosin XVA. Nyligen upptäcktes två mutationer i myosin VI.
Mutationer i myosin VI är c.897G> T och s.926Q. Den första mutationen påverkar en region som interagerar med den aktiva platsen, kallad Switch I. Homozygot för mutationen uppvisar fenotypen tidigt och orsakar allvarliga effekter.
Den andra mutationen påverkar en region av laddade rester, i en alfa-helix i svansen av myosin VI. Denna region är viktig för proximal motordimerisering och påverkar stereokiliärfunktionen hos myosin VI..
En annan mutation är p.Asn207Ser, som producerar en motor som inte kan producera kraft. Detta beror på att Asn 207 är en aminosyrarest av det aktiva stället, vars funktion är bindning och hydrolys av ATP.
P.Arg657Trp-mutationen orsakar förlust av myosin VI-funktionen. Arg-återstoden är inblandad i konformationsförändringarna som kopplar hydrolys till myosins rörelse.
Myosin X och cancer
Myosin X (Myo10) är ett okonventionellt myosin som uttrycks i hjärnan, endotel och många epitel. Myo10 och tre klasser av aktinbaserade projektioner (filopodia, invadopodia och filopodia-liknande projektioner) fungerar under cancermetastaser.
Invasiva cancerceller har ett stort antal filopodia och uttrycker höga nivåer av fascina. Detta protein gör tvärbindningar mellan aktinfilament. För att undkomma den primära tumören bildas invadopodia, rik på proteolytisk aktivitet, som smälter den omgivande extracellulära matrisen..
När cellerna når den extracellulära matrisen, hjälper de filopodia-liknande utsprången att spridas och kolonisera. Höga nivåer av Myo10 indikerar hög aggressivitet och metastaser vid bröstcancer.
MyoX-tystnad orsakar förlust av metastatisk karaktär hos celler, som inte kan bilda aktinbaserade projektioner. Alla dessa utsprång har integrinbaserade vidhäftningar som bärs av Myo10 i filopodium..
MyoX är involverad i bildandet av centrosomen. Frånvaron av MyoX gynnar bildandet av multipolära spindlar. MyoX är också inblandat i signalering i cancerceller. MyoX aktiveras till exempel av 3,4,5, -inositoltrifosfat (PIP3).
Referenser
- Alberts, B., Johnson, A., Lewis, J., et al. 2007. Cellens molekylärbiologi. Garland Science, New York.
- Brownstein, Z., Abu-Rayyan, A., Karfunkel-Doron, D., Sirigu, S., Davido, B., Shohat, M., Frydman, M., Houdusse, A., Kanaan, M., Avraham , K. 2014. Nya myosinmutationer för ärftliga hörselnedsättningar avslöjade genom riktad genomfångst och massivt parallell sekvensering. European Journal of Human Genetics, 22: 768-775.
- Courson, D.S. och Cheney, R.E. 2015. Myosin-X och sjukdom. Experimentell cellforskning, 334: 10-15.
- Lodish, H., Berk, A., Zipurski, S.L., Matsudaria, P., Baltimore, D., Darnell, J. 2003. Cell- och molekylärbiologi. Ledare Medica Panamericana, Buenos Aires, Bogotá, Caracas, Madrid, Mexiko, Sāo Paulo.
- Schliwa, M. och Woehlke, G. 2003. Molekylära motorer. Nature, 422: 759-765.
- Okej, R.D. 2003. Den molekylära motorverktygslådan för intracellulär transport. Cell, 112: 467- 480.


Ingen har kommenterat den här artikeln än.