
Amfipatiska molekylers struktur, egenskaper, exempel
De amfipatiska eller amfifila molekyler De är de som kan känna affinitet eller avstötning samtidigt för ett visst lösningsmedel. Lösningsmedel klassificeras kemiskt som polära eller apolära; hydrofil eller hydrofob. Således kan dessa typer av molekyler "älska" vatten, precis som de också kan "hata" det..
Enligt den tidigare definitionen finns det bara ett sätt för detta att vara möjligt: dessa molekyler måste ha polära och apolära regioner inom sina strukturer; Antingen är de mer eller mindre homogent fördelade (som exempelvis är fallet med proteiner), eller så är de heterogena lokaliserade (när det gäller ytaktiva ämnen)

Ytaktiva medel, även kallade tvättmedel, är kanske de mest kända amfipatiska molekylerna någonsin sedan urminnes tider. Ända sedan människan blev förtrollad av en konstig fysiologi av en bubbla, bekymrad över beredningen av tvålar och rengöringsprodukter, har han stött på fenomenet ytspänning gång på gång.
Att observera en bubbla är detsamma som att bevittna en ”fälla” vars väggar, bildade av inriktningen av amfipatiska molekyler, behåller luftens gasinnehåll. Dess sfäriska former är de mest matematiskt och geometriskt stabila, eftersom de minskar ytspänningen i gränsytan mellan luft och vatten till ett minimum..
Med detta sagt har två andra egenskaper hos amfipatiska molekyler diskuterats: de tenderar att associera eller självmontera, och vissa lägre ytspänningar i vätskor (de som kan göra det kallas ytaktiva medel).
Som ett resultat av den höga tendensen att associera, öppnar dessa molekyler ett fält av morfologiska (och till och med arkitektoniska) studier av deras nanoaggregat och de supramolekyler som komponerar dem; i syfte att designa föreningar som kan funktionaliseras och interagera på obestämbara sätt med celler och deras biokemiska matriser.
Artikelindex
- 1 Struktur
- 1.1 Intermolekylära interaktioner
- 1.2 Diverse
- 2 Egenskaper för amfipatiska molekyler
- 2.1 Förening
- 2.2 Fysisk
- 3 Exempel
- 4 applikationer
- 4.1 Cellmembran
- 4.2 Dispergeringsmedel
- 4.3 Emulgatorer
- 4.4 Tvättmedel
- 4.5 Antioxidanter
- 5 Referenser
Strukturera
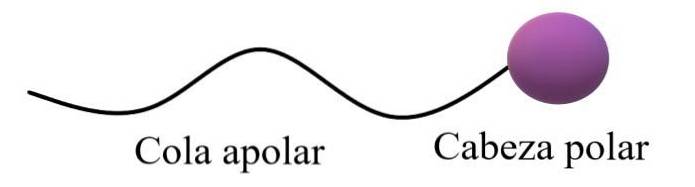
Amfifila eller amfipatiska molekyler sägs ha en polär region och en apolär region. Den apolära regionen består vanligtvis av en mättad eller omättad kolkedja (med dubbla eller trippelbindningar), som representeras som en "apolär svans"; åtföljs av ett "polärt huvud", där de mest elektronegativa atomerna finns.
Den övre allmänna strukturen illustrerar kommentarerna i föregående stycke. Polarhuvudet (lila sfär) kan vara funktionella grupper eller aromatiska ringar som har permanenta dipolmoment och kan också bilda vätebindningar. Därför bör det högsta syre- och kväveinnehållet finnas där.
I detta polära huvud kan det också finnas joniska, negativa eller positiva laddningar (eller båda samtidigt). Denna region är den som visar hög affinitet för vatten och andra polära lösningsmedel..
Å andra sidan samverkar den apolära svansen, med tanke på dess dominerande C-H-bindningar, genom Londons spridningskrafter. Denna region är ansvarig för det faktum att amfipatiska molekyler också visar affinitet för fetter och apolära molekyler i luften (Ntvå, COtvå, Ar, etc.).
I vissa kemiska texter jämförs modellen för den övre strukturen med formen på en klubba.
Intermolekylära interaktioner
När en amfipatisk molekyl kommer i kontakt med ett polärt lösningsmedel, t.ex. vatten, har dess regioner olika effekter på lösningsmedelsmolekylerna..
Till att börja med försöker vattenmolekylerna att solvatera eller hydratera det polära huvudet och hålla sig borta från den apolära svansen. I denna process skapas molekylär störning.
Under tiden tenderar vattenmolekylerna runt den apolära svansen att ordna sig som om de var små kristaller, vilket gör att de kan minimera avstötningar. I denna process skapas en molekylär ordning.
Mellan störningar och ordningar kommer det en punkt där den amfipatiska molekylen kommer att försöka interagera med en annan, vilket kommer att resultera i en mycket mer stabil process.
Övrigt
Båda kommer att nås genom sina apolära svansar eller polarhuvuden, på ett sådant sätt att relaterade regioner interagerar först. Detta är detsamma som att föreställa sig att två "lila klubbor" i bilden ovan, närmar sig genom att fläta ihop sina svarta svansar eller förena sina två lila huvuden..
Och därmed börjar ett intressant associeringsfenomen, där flera av dessa molekyler förenas i följd. De är inte godtyckligt associerade, men enligt en serie strukturella parametrar, som slutar isolera de apolära svansarna i ett slags "apolär kärna", samtidigt som de polära huvuden utsätts för ett polärt skal..
Det sägs då att en sfärisk miscella har fötts. Men under bildandet av miscellen finns det ett preliminärt steg bestående av det som kallas ett lipid dubbelskikt. Dessa och andra är några av de många makrostrukturer som amfifila molekyler kan använda.
Kännetecken för amfipatiska molekyler
Förening

Om de apolära svansarna tas som svarta enheter, och polarhuvudena är lila enheter, kommer det att förstås varför barken på bältet är lila i dess övre bild och dess kärna är svart. Kärnan är apolär och dess interaktioner med vatten- eller lösningsmedelsmolekylerna är noll..
Om lösningsmedlet eller mediet å andra sidan är apolärt, är det de polära huvuden som kommer att drabbas av avstötningar och följaktligen kommer de att vara placerade i mitten av miscellaen; det vill säga det är inverterat (A, lägre bild).
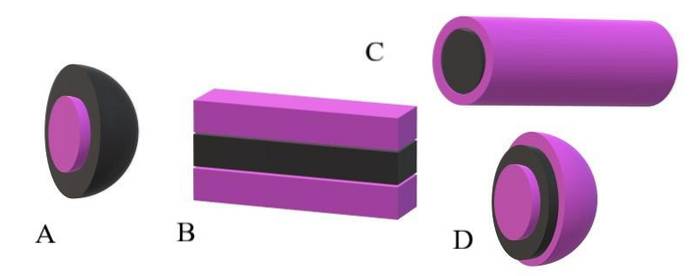
Det observeras att den inverterade miscellen har ett svart apolärt skal och en lila polarkärna. Men innan misceller bildas, hittas de amfifila molekylerna individuellt och ändrar ordningen på lösningsmedelsmolekylerna. Ökad koncentration, de börjar associera i en struktur med ett eller två lager (B).
Från B börjar laminerna att kurva för att bilda D, en vesikel. En annan möjlighet, beroende på formen på den apolära svansen med avseende på dess polära huvud, är att de associerar för att ge upphov till en cylindrisk miscella (C).
Nanoaggregat och supramolekyler
Det finns därför fem huvudstrukturer som avslöjar en grundläggande egenskap hos dessa molekyler: deras höga tendens att associeras och självmonteras till supramolekyler, som aggregerar för att bilda nanoaggregat..
Således finns amfifila molekyler inte ensamma utan i förening..
Fysisk
Amfipatiska molekyler kan vara neutrala eller joniskt laddade. De som har negativa laddningar har en syreatom med en negativ formell laddning i sitt polära huvud. Några av dessa syreatomer kommer från funktionella grupper såsom: -COO-, -SW4-, -SW3- eller -PO4-.
När det gäller positiva laddningar kommer de i allmänhet från aminer, RNH3+.
Närvaron eller frånvaron av dessa laddningar förändrar inte det faktum att dessa molekyler i allmänhet bildar kristallina fasta ämnen; eller, om de är relativt lätta, finns de som oljor.
Exempel
Några exempel på amfipatiska eller amfifila molekyler kommer att nämnas nedan:
-Fofolipider: fosfatidyletanolamin, sfingomyelin, fosfatidylserin, fosfatidylkolin.
-Kolesterol.
-Glykolipider.
-Natriumlaurylsulfat.
-Proteiner (de är amfifila, men inte tensider).
-Fenoliska fetter: kardanol, kardoler och anakardiella syror.
-Cetyltrimetylammoniumbromid.
-Fettsyror: palmitinsyra, linoleinsyra, oljesyra, laurinsyra, stearinsyra.
-Långkedjiga alkoholer: 1-dodekanol och andra.
-Amfifila polymerer: såsom etoxylerade fenolhartser.
Applikationer
Cellmembran
En av de viktigaste konsekvenserna av dessa molekylers förmåga att associera är att de bygger en slags vägg: lipid dubbelskiktet (B).
Detta dubbelskikt sträcker sig för att skydda och reglera inträde och utgång av föreningar i celler. Det är dynamiskt, eftersom dess apolära svansar roterar och hjälper amfipatiska molekyler att röra sig..
På samma sätt, när detta membran är fäst i två ändar, för att ha det vertikalt, används det för att mäta dess permeabilitet; och med detta erhålls värdefulla data för design av biologiska material och syntetiska membran från syntesen av nya amfipatiska molekyler med olika strukturella parametrar..
Dispergeringsmedel
Inom oljeindustrin används dessa molekyler och polymererna syntetiserade från dem för att dispergera asfaltener. Fokus för denna ansökan vilar på hypotesen att asfaltener består av en kolloidformig fast substans, med en hög tendens att flockas och sedimentera som ett brunsvart fast ämne som orsakar allvarliga ekonomiska problem..
Amfipatiska molekyler hjälper till att hålla asfaltener spridda under en längre tid inför fysikalisk-kemiska förändringar i råoljan..
Emulgatorer
Dessa molekyler hjälper till att blanda två vätskor som inte skulle vara blandbara under vanliga förhållanden. I glassar hjälper de till exempel vatten och luft att bilda en del av samma fasta ämne tillsammans med fett. Bland de mest använda emulgeringsmedlen för detta ändamål är de härledda från ätbara fettsyror.
Tvättmedel
Den amfifila karaktären hos dessa molekyler används för att fånga fett eller apolära föroreningar, för att senare transporteras bort samtidigt av ett polärt lösningsmedel, såsom vatten..
Precis som exemplet med bubblor där luft fångats, fångar rengöringsmedel fett i sina miceller, som, med ett polärt skal, samverkar effektivt med vatten för att avlägsna smuts..
Antioxidanter
Polarhuvudena är av avgörande betydelse eftersom de definierar de många användningsområden som dessa molekyler kan ha i kroppen.
Om de till exempel har en uppsättning aromatiska ringar (inklusive derivat av en fenolring) och polära ringar som kan neutralisera fria radikaler, kommer det att finnas amfifila antioxidanter; och om de också saknar toxiska effekter kommer det att finnas nya antioxidanter tillgängliga på marknaden.
Referenser
- Alberts B, Johnson A, Lewis J, et al. (2002). Molekylärbiologi av cellen. 4: e upplagan. New York: Garland Science; Lipid Bilayer. Återställd från: ncbi.nlm.nih.gov
- Jianhua Zhang. (2014). Amfifila molekyler. Springer-Verlag Berlin Heidelberg, E. Droli, L. Giorno (red.), Encyclopedia of Membranes, DOI 10.1007 / 978-3-642-40872-4_1789-1.
- Sa Joseph. (2019). Definition av amfipatiska molekyler. Studie. Återställd från: study.com
- Lehninger, A. L. (1975). Biokemi. (2: a upplagan). Worth Publishers, Inc..
- Mathews, C. K., van Holde, K. E. och Ahern, K. G. (2002). Biokemi. (3: e upplagan). Pearson Addison Weshley.
- Helmenstine, Anne Marie, Ph.D. (31 mars 2019). Vad är ett ytaktivt medel? Återställd från: thoughtco.com
- Domenico Lombardo, Mikhail A. Kiselev, Salvatore Magazù och Pietro Calandra (2015). Amfifiler självmontering: grundläggande begrepp och framtida perspektiv på supramolekylära tillvägagångssätt. Advances in Condensed Matter Physics, vol. 2015, artikel-ID 151683, 22 sidor, 2015. doi.org/10.1155/2015/151683.
- Anankanbil S., Pérez B., Fernandes I., Magdalena K. Widzisz, Wang Z., Mateus N. & Guo Z. (2018). En ny grupp syntetiska fenolinnehållande amfifila molekyler för mångsidiga tillämpningar: Fysikalisk-kemisk karakterisering och celltoxicitetsstudie. Vetenskapliga rapporter Volym 8, artikelnummer: 832.


Ingen har kommenterat den här artikeln än.