
Icke-metallhistorik, egenskaper, grupper, användningar
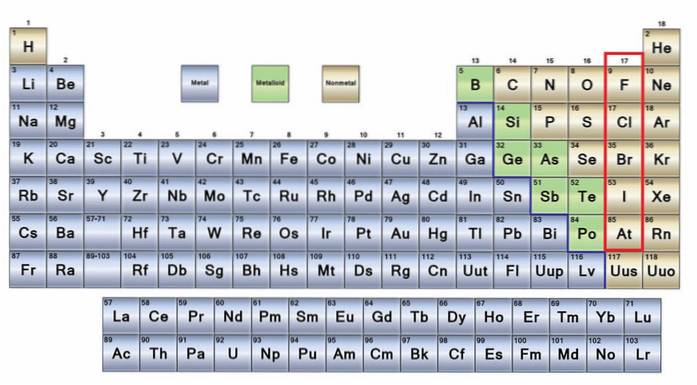
De inga metaller De är en grupp av element som finns på höger sida av det periodiska systemet, med undantag av väte som finns i grupp 1 (IA), tillsammans med alkalimetallerna. Om du vill veta vad de är måste du titta på det övre högra hörnet av p-blocket.
Icke-metallatomer är relativt små och deras yttre elektroniska skal har ett stort antal elektroner. Bland de icke-metalliska elementen kan vara fasta ämnen, vätskor och gaser; även om de flesta av dem är i gasform, berikar flera av dem atmosfären.
En god del av icke-metaller finns i alla levande varelser i form av föreningar och makromolekyler. Till exempel: kol, syre och väte finns i alla proteiner, lipider, kolhydrater och nukleinsyror.
Fosfor finns i alla nukleinsyror och i vissa kolhydrater och lipider. Svavel finns i många proteiner. Kväve är en del av alla nukleinsyror och proteiner.
Å andra sidan består underjordiska metangaser och råolja nästan helt av icke-metalliska element. Faktum är att kolväten (kol och väte) ger en uppfattning om hur rikligt icke-metaller finns trots deras lägre antal element i det periodiska systemet..
Artikelindex
- 1 Historia
- 2 Fysikaliska och kemiska egenskaper
- 2.1 Fysik
- 2.2 Kemi
- 3 grupper av icke-metaller och grundämnen
- 3.1 Grupp 1
- 3.2 Grupp 14
- 3.3 Grupp 15
- 3.4 Grupp 16
- 3.5 Grupp 17
- 3.6 Grupp 18
- 4 användningsområden
- 4.1 Väte
- 4.2 Kol
- 4.3 Kväve
- 4.4 Fosfor
- 4.5 Syre
- 4.6 Svavel
- 4.7 Selen
- 4.8 Fluor
- 4.9 Klor
- 4.10 Brom
- 4.11 Jod
- 4.12 Helium
- 4.13 Neon
- 4.14 Argon
- 4.15 Xenon
- 4.16 Radon
- 5 Referenser
Berättelse
Sedan urminnes tider (3750 f.Kr.) använde egyptierna kol för att minska koppar som finns i sina mineraler, såsom korvellit och malakit..
År 1669 lyckades Hennin Brand isolera fosfor från uppsamlad urin. Henry Cavendish (1776) lyckades identifiera väte, även om flera forskare, inklusive Robert Boyle (1670), producerade väte genom att reagera en stark syra med en metall.
Carl Scheele producerade syre genom upphettning av kvicksilveroxid med nitrater (1771). Curtois lyckades isolera jod medan han försökte förbereda saltpeter från tång (1811). Balard och Gmelin isolerad brom (1825).
År 1868 upptäckte Janssen och Lockger oberoende helium genom att observera en gul linje i studien av spektrum av solljus som inte tillhörde ett annat element. Moissan lyckades isolera fluor (1886).
1894 upptäckte Lord Rayleigh och Ramsey argon genom att studera kväveegenskaperna. Ramsay och Travers (1898) isolerade krypton, neon och xenon från flytande argon genom kryogen destillation av luft..
Fysiska och kemiska egenskaper

Fysisk
Några av de fysiska egenskaperna hos icke-metaller är:
-De har låg elektrisk konduktans, förutom kol i form av grafit, vilket är en bra elektriskt ledare..
-De kan förekomma under det fysiska utseendet på fasta ämnen, vätskor eller gaser.
-De har låg värmeledning, förutom kol i form av diamant, som inte beter sig som en värmeisolator..
-De har låg glans, till skillnad från metallglans av metaller.
-Icke-metalliska fasta ämnen är spröda, så de är inte duktila eller formbara.
-De har låga smältpunkter och kokpunkter.
-De kan ha olika kristallina strukturer. Således har fosfor, syre och fluor en kubisk kristallstruktur; väte, kol och kväve, hexagonalt; och svavel, klor, brom och jod, ortorombisk.
Kemi
Icke-metaller kännetecknas av att de har en hög joniseringsenergi och ett högt elektronegativitetsvärde. Fluor har till exempel den högsta elektronegativiteten (3,98), och är det mest reaktiva elementet i icke-metaller.
Men överraskande nog har ädelgaserna helium (5.5) och neon (4.84) den högsta elektronegativiteten. De är emellertid kemiskt inerta eftersom de yttre elektroniska skalen är fyllda..
Icke-metaller bildar jonföreningar med metaller och kovalenta med icke-metaller.
Icke-metalliska element finns som bildar diatomiska molekyler, kopplade genom kovalenta bindningar. Under tiden är ädelgasernas atomer i form av atomenheter.
De bildar sura oxider som, när de reagerar med vatten, ger upphov till syror.
Icke-metalliska grupper och element
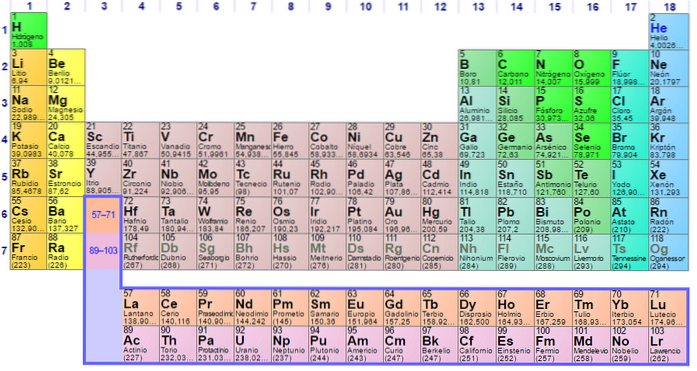
Grupp 1
Den består av väte, en färglös och luktfri gas, diatomisk. Oxidationstillstånd +1. Den har en lägre densitet än luft. I fast tillstånd har den en sexkantig kristallstruktur. Väte är ett dåligt reaktivt element.
Grupp 14
Kol är det enda icke-metall i denna grupp. Kol i form av grafit är ett glänsande fast ämne med en sexkantig kristallstruktur. Den har hög elektrisk ledningsförmåga. Dess vanligaste oxidationstillstånd är +2 och +4.
Grupp 15
Kväve
Färglös och luktfri gas. Det är ett lite reaktivt element och lite tätare än luft. Vanligaste oxidationstillstånd: -3 och +5. Bildar diatomiska molekyler, Ntvå.
Match
Fast, dess färg kan vara vit, gul eller svart. Lite reaktivt. Ortorhombisk kristallstruktur. Elektronegativitet 2.1. Vanligaste oxidationstillstånd: -3 och +5.
Grupp 16
Syre
Färglös eller ljusblå gas, luktfri. Generellt icke-reaktivt. Kubisk kristallstruktur. Det är en isolator och ett starkt oxidationsmedel. Elektronegativitet 3.5. Oxidationstillstånd -2
Svavel
Lysande gult fast, sprött, måttligt reaktivt. Ortorhombisk kristallstruktur. Bildar kovalenta bindningar. Elektronegativitet 2.5. Vanligaste oxidationstillstånd: -2, +2, +4 och +6.
Selen
Fast grå eller röd till svart. Grått selen uppvisar ljuskänslig elektrisk ledningsförmåga. Det är ett mjukt och sprött fast ämne. Elektronegativitet 2.4. Oxidationstillstånd: -2, +2, +4 och +6.
Grupp 17
Fluor
Det är en blekgul gas, mycket giftig. Det är ett mycket reaktivt element. Det förekommer som diatomiska molekyler, Ftvå. I fast tillstånd kristalliserar den i kubisk form. Elektronegativitet 3.98. Oxidationstillstånd -1.
Klor
Det är en grön-gul gas. Den presenterar diatomiska molekyler, Cltvå. Det är väldigt reaktivt. I fast tillstånd är den kristallina strukturen ortorombisk. Elektronegativitet 3.0. Oxidationstillstånd: - 1, +1, +3, +5, +7.
Brom
Det är en rödbrun vätska. Elektronegativitet 2.8. Oxidationstillstånd -1, +1, +3, +5 och +7.
Jod
Det är ett svart fast ämne som vid sublimering avger en violett ånga. Ortorhombisk kristallstruktur. Metalljodider är joniska. Elektronegativitet 2.5. Oxidationstillstånd: -1, +1, +3, +5 och +7.
Astatus
Det är en helt svart. Ansiktscentrerad kubisk kristallstruktur. Elektronegativitet 2.2. Det är ett svagt oxidationsmedel.
Grupp 18
Helium
Den har hög värmeledningsförmåga. Elektronegativitet 5.5. Det är kemiskt inert och icke brandfarligt. Låg densitet och hög flytbarhet.
Neon
Hög kylkapacitet i flytande tillstånd. Elektronegativitet 4,84. Det är den minst reaktiva av ädelgaserna.
Argon
Det är tätare än luft. Kemiskt inert. Elektronegativitet 3.2.
Krypton
Elektronegativitet 2,94. Kan reagera med fluor för att bilda kryptondifluorid (KrFtvå).
Xenon
Det passerar blod-hjärnbarriären. Den svarar på elektrisk ström genom att producera ljus. Elektronegativitet 2.2. Bildar komplex med fluor, guld och syre.
Radon
Det är ett radioaktivt element. Elektronegativitet 2.06. Bildar föreningar med fluor (RnFtvå) och med syre (RnO3).
Applikationer
Väte
Den används i raketdrivning och som bränsle i bilmotorer som använder väte. Det används vid syntes av ammoniak (NH3) och vid hydreringen av fetter.
Kol

Grafit används vid tillverkning av pennor och höghållfasta fibrer som används vid tillverkning av sportartiklar. Diamant används som en pärla av stort värde och i borrhål som slipmedel. Koldioxid används vid produktion av kolsyrade drycker.
Kväve
Det används vid produktion av ammoniak, salpetersyra och urea. Kväve är ett väsentligt element för växter och används vid tillverkning av gödselmedel.
Match
Vit fosfor används som rodenticid, insektsmedel och i fyrverkeriindustrin. Röd fosfor används för att göra tändstickor. Dess föreningar används också vid produktion av gödselmedel.
Syre
Syre används vid tillverkning av stål, plast och textilier. Det används också i raketdrivmedel, syrebehandling och andningshjälp i flygplan, ubåtar och rymdflyg..
Svavel
Det används som råvara för produktion av svavelsyra, krut och vid vulkanisering av gummi. Sulfiter används för att bleka papper och fungicid.
Selen
Den används för att ge glasrött en röd röd nyans. Det används också för att neutralisera den grönaktiga nyansen som produceras genom förorening av glaset med järnföreningar. Den används i fotoelektriska celler med applikation i dörrar och hissar.
Fluor

Det läggs till tandkrämer för att förhindra håligheter. Vätefluorid används som råvara för teflon. Monatomisk fluor används vid tillverkning av halvledare.
Klor
Det används i extraktionsmetallurgi och vid klorering av kolväten för tillverkning av olika produkter såsom PVC. Klor används i trämassa och textilblekmedel. Det används också som vattendesinfektionsmedel.
Brom
Det används vid framställning av silverbromid för ljuskänsliga linser och i fotografisk film. Det används också vid tillverkning av den lugnande natriumbromiden och dibrometan, en antiknockkomponent i bensin.
Jod
Kaliumjodid (KI) tillsätts för att förhindra sköldkörteln. Tinktur av jod används som ett antiseptiskt medel och bakteriedödande medel. Jod är en del av sköldkörtelhormonerna.
Helium
Den används vid fyllning av luftballonger och blandas med syre för djupvattenandning. Den används för svetsning i en inert atmosfär och hjälper också till att hålla mycket låga temperaturer i forskning.
Neon
I glasrör som är upplysta av kraftens verkan (röda neonljus).
Argon
Används för att skapa en atmosfär för svetsning och vid påfyllning av glödlampor.
Xenon
En blandning av xenon och krypton används vid produktion av högintensiva blixtar i korta fotografiska exponeringar.
Radon
Det används vid behandling av cancertumörer genom strålbehandling.
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan). CENGAGE Learning.
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Mathews, C. K., van Holde, K. E. och Ahern, K. G. (2002). Biokemi. Tredje upplagan. Redigera. Pearson-Addison Wesley
- Helmenstine, Anne Marie, Ph.D. (06 oktober 2019). Vilka är egenskaperna hos icke-metaller? Återställd från: thoughtco.com
- Wikipedia. (2019). Icke-metall. Återställd från: en.wikipedia.org
- Redaktörerna för Encyclopaedia Britannica. (5 april 2016). Icke-metall. Encyclopædia Britannica. Återställd från: britannica.com
- José M. Gavira Vallejo. (2016, 27 januari). Vilka är de polygena elementen? Och icosagens, crystallógens, chalcogens ...? Återställd från: triplenlace.com



Ingen har kommenterat den här artikeln än.