
Oxihemoglobinegenskaper, struktur och bindningskurva
ELLERxihemoglobin Det är namnet som hemoglobin får när det binder till syre. Hemoglobin är ett protein som finns i röda blodkroppar vars huvudsakliga funktion är att transportera syre från lungorna till vävnaderna..
De första levande varelserna var encelliga och levde i en flytande miljö från vilken de fick näring och från vilka de eliminerade sitt avfall, som några av de organismer som finns idag. Under dessa förhållanden uppnås dessa processer med enkla diffusionsmekanismer, eftersom cellväggen är i intim kontakt med mediet som levererar den..
Utvecklingen av alltmer komplexa flercelliga organismer antydde att de inre cellerna rörde sig avsevärt bort från miljön, så att diffusionsmekanismerna som enda försörjningskälla blev otillräckliga..
Således utvecklades specialiserade system för att erhålla näringsämnen och gaser som matsmältningssystemet och andningsorganen, samt transportmekanismer för att föra dessa näringsämnen och gaser närmare cellen: det kardiovaskulära systemet.
För att producera energi i form av ATP-molekyler behöver celler syre. Eftersom ATP inte kan lagras måste den syntetiseras ständigt, vilket innebär en permanent efterfrågan på syre av cellerna..
Hemoglobin framkom evolutionsmässigt som en gastransportör som "löste" problemet med syretransport från miljön till cellen..
Artikelindex
- 1 Egenskaper och struktur
- 1.1 Vad är hemoglobin för?
- 1.2 Hur ser en hemoglobinmolekyl ut?
- 1.3 Hur är hemgruppen?
- 1.4 Hur bildas oxihemoglobin?
- 1.5 Vad är den maximala mängden syre som hemoglobin kan bära?
- 2 Oxihemoglobinbindningskurva
- 3 Referenser
Egenskaper och struktur
För att prata om egenskaperna och strukturen hos oxihemoglobin är det nödvändigt att hänvisa till hemoglobin, eftersom oxihemoglobin inte är något annat än hemoglobin bundet till syre. Därför kommer molekylens gemensamma egenskaper från och med nu att beskrivas i närvaro av gasen i fråga..
Vad är hemoglobin för?
Hemoglobin är nödvändigt för att transportera syre till vävnaderna i den mängd och hastighet som dessa kräver, med tanke på att syre har så lite löslighet i blodet att dess transport genom diffusion skulle vara otillräcklig för att tillgodose vävnadsbehov.
Hur är en hemoglobinmolekyl?
Hemoglobin är ett tetrameriskt protein (som har fyra underenheter), har en sfärisk form och en molekylvikt på 64 kDa.
Dess fyra underenheter utgör en enda funktionell enhet, där var och en påverkar varandra ömsesidigt. Varje subenhet består av en polypeptidkedja, globin och en protesgrupp, hem- eller "hem" -gruppen, som fungerar som en kofaktor och inte består av aminosyror; det vill säga det är inte protein i naturen.
Globin finns i två former: alfa-globin och beta-globin. Hemoglobintetrameren består av ett par alfa-globinkedjor (med 141 aminosyror) och ett par beta-globinkedjor (av 146 aminosyror).
Var och en av de fyra polypeptidkedjorna är bundna till en hemgrupp, som har en järnatom i centrum i järnhaltigt tillstånd (Fe2 +).
Hur är hemgruppen?
Hemgruppen är en porfyrinring som består av fyra pyrroliska ringar (heterocykliska aromatiska föreningar med formeln C4H5N) kopplade av metylbryggor. Järnet i det järnhaltiga tillståndet som är i centrum fästs på strukturen genom koordinerade kvävebindningar.
Varje hemgrupp kan binda till en syremolekyl, så varje hemoglobinmolekyl kan endast binda 4 molekyler av gasen.
Människokroppen innehåller cirka 2,5 x 1013 erytrocyter, vilket är de blodkroppar som bildar och transporterar hemoglobin. Varje erytrocyt har cirka 280 miljoner hemoglobinmolekyler och kan sedan bära mer än 1 miljard syremolekyler.
Hur bildas oxihemoglobin?
Oxihemoglobin bildas efter förening av en syreatom till varje järnatom i ferrotillståndet som finns i varje hemgrupp i hemoglobinmolekylen.
Uttrycket oxihemoglobin hänvisar sedan till ett syresatt och inte kemiskt oxiderat hemoglobin, eftersom det inte förlorar en elektron när det kombineras med syre och järn förblir i ett järnhaltigt tillstånd..
Oxygenering producerar en förändring i molekylens kvaternära struktur, det vill säga en förändring i konformation som kan överföras från globinkedjorna till hemgruppen och vice versa..
Vad är den maximala mängden syre som hemoglobin kan bära?
Hemoglobin kan högst binda fyra syremolekyler i sin struktur. Om molvolymen av ideala gaser är 22,4 L / mol, kommer en mol hemoglobin (64 500 g) att binda med 89,6 liter syre (4 mol O2 x 22,4 L / mol).
Så varje gram hemoglobin måste binda 1,39 ml O2 för att vara 100% mättat (89,6 l / 64500 g x (1000 ml / l)).
I praktiken ger blodprov något lägre resultat, eftersom det finns små mängder metemoglobin (oxiderat hemoglobin) och karboxihemoglobin (hemoglobin + kolmonoxid (CO)) som inte kan binda syre.
Med hänsyn till detta fastställer "Hüfner" -regeln att 1g hemoglobin i blodet har en maximal kapacitet att binda syre på 1,34 ml.
Oxihemoglobinbindningskurva
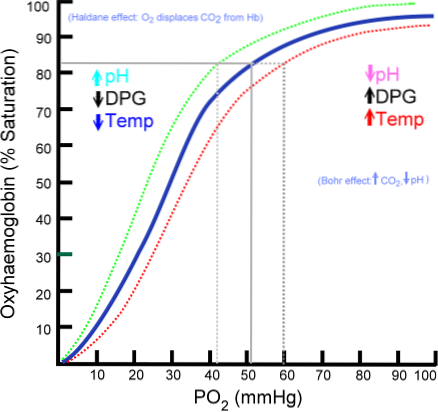
Antalet syremolekyler som kan binda till en hemoglobinmolekyl beror på partiellt tryck av syre eller PO2. I frånvaro av syre avoxideras hemoglobin, men när PO2 ökar ökar antalet oxygener som binder till hemoglobin..
Processen att binda syre till hemoglobin beroende av partiellt tryck av syre. När det plottas kallas resultatet "oxihemoglobinkurvan" och har en karakteristisk "S" eller sigmoid form..
Beroende på PO2 kommer hemoglobin att vara mindre eller mer kapabelt att "släppa ut" eller "avge" syret som det bär, såväl som att det fylls med det..
Till exempel, i området mellan 10 och 60 mmHg tryck, erhålls den brantaste delen av kurvan. I detta tillstånd kan hemoglobin enkelt ge upp stora mängder O2. Detta är det tillstånd som uppnås i vävnaderna.
När PO2 är mellan 90 och 100 mmHg (12 till 13 kPa) är hemoglobin nästan 100% mättat med O2; och när arteriell PO2 är 60 mmHg (8 kPa) är O2-mättnad fortfarande så hög som 90%.
I lungorna är dessa förhållanden som råder (tryck mellan 60 och 100 mmHg), och det är detta som gör att hemoglobinmolekylerna i erytrocyterna kan laddas med syre..
Denna sigmoidform som drar oxyhemoglobinkurvan säkerställer att detta protein beter sig som en utmärkt lunglastare, en mycket effektiv transportör i arteriellt blod och en utmärkt O2-donator i vävnader, i proportion till den lokala metaboliska hastigheten..
Referenser
- Fox, S. I. (2006). Human Physiology 9th Edition (s. 501-502). McGraw-Hill press, New York, USA.
- Murray, R. K., Granner, D. K., Mayes, P. A., & Rodwell, V. W. (2014). Harpers illustrerade biokemi. McGraw-Hill.
- Rawn, J. D. (1998). Biokemi (1989). Burlington, North Carolina: Neil Patterson Publishers (c) N. Lalioti, CP Raptopoulou, A. Terzis, A. Panagiotopoulos, SP Perlepes, E. Manessi-Zoupa, J. Chem. Soc. Dalton Trans., 1327.
- Robert M. Berne, Matthew N. Levy. (2001) Fysiologi. (3: e upplagan) Ediciones Harcourt, S.A.
- West, J. B. (1991). Fysiologisk grund för medicinsk praxis. Williams & Wilkins



Ingen har kommenterat den här artikeln än.