
Bariumperoxid (BaO2) struktur, egenskaper och användningsområden

De bariumperoxid är en jonisk och oorganisk förening vars kemiska formel är BaOtvå. Att vara en jonförening, den består av Ba-jonertvå+ migtvåtvå-; den senare är vad som kallas peroxidanjonen, och på grund av det BaOtvå förvärvar sitt namn. Detta är fallet, BaOtvå är en oorganisk peroxid.
Avgifterna för dess joner avslöjar hur denna förening bildas av elementen. Grupp 2 bariummetall ger två elektroner till syremolekylen, Otvå, vars atomer inte används för att reducera sig till oxidanjoner, ELLERtvå-, men hålls samman av en enkel länk, [O-O]två-.

Bariumperoxid är en granulär fast substans vid rumstemperatur, vit i färg med svaga gråtoner (övre bild). Som nästan alla peroxider måste den hanteras och lagras med försiktighet, eftersom det kan påskynda oxidationen av vissa ämnen.
Av alla peroxider bildade av grupp 2-metaller (Mr. Becambara), BaOtvå den är termodynamiskt den mest stabila mot dess termiska nedbrytning. Vid uppvärmning släpper det ut syre och bariumoxid, BaO, produceras. BaO kan reagera med syre i miljön, vid höga tryck, för att bilda BaO igentvå.
Artikelindex
- 1 Struktur
- 1.1 Kristallgitterenergi
- 1.2 Hydrater
- 2 Beredning eller syntes
- 3 fastigheter
- 3.1 Fysiskt utseende
- 3.2 Molekylär massa
- 3.3 Densitet
- 3.4 Smältpunkt
- 3.5 Kokpunkt
- 3.6 Löslighet i vatten
- 3.7 Termisk nedbrytning
- 4 Nomenklatur
- 5 användningsområden
- 5.1 Syreproducent
- 5.2 Producent av väteperoxid
- 6 Referenser
Strukturera
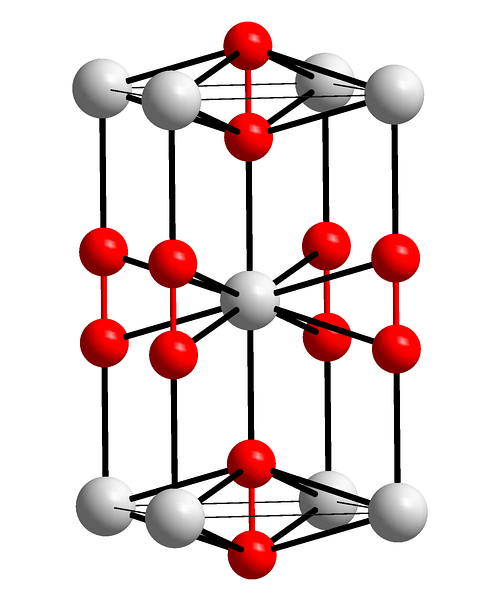
Den övre bilden visar den tetragonala enhetscellen av bariumperoxid. Inuti kan man se katjonerna Batvå+ (vita sfärer) och anjonerna Otvåtvå- (röda sfärer). Observera att de röda sfärerna är förenade med en enda bindning, så de representerar linjär geometri [O-O]två-.
Från denna enhetscell kan BaO-kristaller byggastvå. Om det observeras anjonen Otvåtvå- det ses vara omgivet av sex Batvå+, att erhålla en oktaeder vars hörn är vita.
Å andra sidan, ännu tydligare, varje Batvå+ är omgiven av tio Otvåtvå- (vit sfär i mitten). Hel kristall består av denna konstanta korta och långa räckvidd.
Kristallgitter energi
Om de röda vita kulorna också observeras, kommer det att noteras att de inte skiljer sig för mycket i storlek eller jonradie. Detta beror på att Ba-katjonentvå+ är mycket skrymmande, och dess interaktioner med anjonen Otvåtvå- stabilisera kristallens gitterenergi i bättre utsträckning jämfört med hur exempelvis katjoner skulletvå+ och Mgtvå+.
Detta förklarar också varför BaO är den mest instabila av alkaliska jordoxider: Ba-joner.två+ migtvå- skiljer sig avsevärt i storlek, destabiliserar deras kristaller.
Eftersom det är mer instabilt, desto lägre är trenden med BaOtvå sönderdelas för att bilda BaO; strider mot peroxider SrOtvå, CaOtvå och MgOtvå, vars oxider är mer stabila.
Hydrater
BaOtvå kan hittas i form av hydrater, av vilka BaOtvå∙ 8HtvåEller det är det mest stabila av alla; och faktiskt är detta den som marknadsförs istället för den vattenfria bariumperoxiden. För att få den vattenfria måste BaO torkas vid 350 ° Ctvå∙ 8HtvåEller för att ta bort vattnet.
Dess kristallstruktur är också tetragonal, men med åtta molekyler av HtvåO interagerar med Otvåtvå- genom vätebindningar och med Batvå+ genom dipoljoninteraktioner.
Andra hydrater, vars strukturer det inte finns mycket information om i detta avseende, är: BaOtvå∙ 10HtvåO, BaOtvå∙ 7HtvåO och BaOtvå∙ HtvåELLER.
Beredning eller syntes
Den direkta beredningen av bariumperoxid består av oxidationen av dess oxid. Detta kan användas från mineralbarit eller från bariumnitratsalt, Ba (NO3)två; båda värms upp i en luft- eller syreberikad atmosfär.
En annan metod består i att reagera Ba (NO3)två med natriumperoxid:
Bad3)två + NatvåELLERtvå + xHtvåO => BaOtvå∙ xHtvåO + 2NaNO3
Sedan hydrerar BaOtvå∙ xHtvåEller det utsätts för uppvärmning, filtreras och avslutas genom torkning med vakuum.
Egenskaper
Fysiskt utseende
Det är ett vitt fast ämne som kan bli gråaktigt om det har föroreningar (antingen BaO, Ba (OH)två, eller andra kemiska arter). Om den värms upp till en mycket hög temperatur kommer den att avge grönaktiga lågor på grund av de elektroniska övergångarna av Ba-kationerna.två+.
Molekylär massa
169,33 g / mol.
Densitet
5,68 g / ml.
Smältpunkt
450 ° C.
Kokpunkt
800 ° C Detta värde överensstämmer med vad som kan förväntas av en jonförening; och ännu mer av den mest stabila jordalkaliska peroxiden. BaO kokar dock inte riktigttvå, snarare frigörs gasformigt syre som ett resultat av dess termiska nedbrytning.
Vattenlöslighet
Olöslig. Det kan dock långsamt genomgå hydrolys för att producera väteperoxid, HtvåELLERtvå; och dessutom ökar dess löslighet i vattenhaltigt medium om en utspädd syra tillsätts.
Termisk sönderdelning
Följande kemiska ekvation visar den termiska nedbrytningsreaktionen som BaO genomgårtvå:
2BaOtvå <=> 2BaO + Otvå
Reaktionen är enkelriktad om temperaturen är över 800 ° C. Om trycket höjs omedelbart och temperaturen sjunker kommer allt BaO att omvandlas till BaOtvå.
Nomenklatur
Ett annat sätt att namnge BaOtvå det är bariumperoxid, enligt den traditionella nomenklaturen; eftersom barium bara kan ha valensen +2 i dess föreningar.
Felaktigt används den systematiska nomenklaturen för att hänvisa till den som bariumdioxid (binoxid), med tanke på att den är en oxid och inte en peroxid..
Applikationer
Syreproducent
Med hjälp av mineral barit (BaO) värms den upp med luftströmmar för att eliminera dess syreinnehåll, vid en temperatur på cirka 700 ° C..
Om den resulterande peroxiden värms försiktigt under vakuum regenereras syret snabbare och bariten kan återanvändas på obestämd tid för att lagra och producera syre..
Denna process utformades kommersiellt av L. D. Brin, nu föråldrad.
Väteperoxidproducent
Bariumperoxid reagerar med svavelsyra för att producera väteperoxid:
Stråletvå + HtvåSW4 => HtvåELLERtvå + Baso4
Det är därför en källa till HtvåELLERtvå, manipuleras särskilt med dess hydrat BaOtvå∙ 8HtvåELLER.
Enligt dessa två nämnda användningsområden, BaOtvå möjliggör utveckling av Otvå och HtvåELLERtvå, både oxidationsmedel, i organisk syntes och i blekningsprocesser inom textil- och färgindustrin. Det är också ett bra desinfektionsmedel..
Dessutom från BaOtvå andra peroxider kan syntetiseras, såsom natrium, NatvåELLERtvå, och andra bariumsalter.
Referenser
- S.C. Abrahams, J Kalnajs. (1954). Kristallstrukturen av bariumperoxid. Laboratory for Insulation Research, Massachusetts Institute of Technology, Cambridge, Massachusetts, USA.
- Wikipedia. (2018). Bariumperoxid. Återställd från: en.wikipedia.org
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). Mc Graw Hill.
- Atomik. (2012). Bariumperoxid. Återställd från: barium.atomistry.com
- Khokhar et al. (2011). Studie av beredning av laboratorieskala och utveckling av en process för bariumperoxid. Återställd från: academia.edu
- PubChem. (2019). Bariumperoxid. Återställd från: pubchem.ncbi.nlm.nih.gov
- PrebChem. (2016). Beredning av bariumperoxid. Återställd från: prepchem.com


Ingen har kommenterat den här artikeln än.