
Aufbau principbegrepp och förklaring, exempel
De Aufbau-principen Den består av en användbar guide för att teoretiskt förutsäga den elektroniska konfigurationen av ett element. Ordet aufbau hänvisar till det tyska verbet "att bygga." Reglerna som dikteras av denna princip är avsedda att "hjälpa till att bygga atomen".
När man talar om den hypotetiska atomkonstruktionen hänvisar den uteslutande till elektroner, som i sin tur går hand i hand med det ökande antalet protoner. Protoner definierar atomnummer Z för ett kemiskt element, och för varje som läggs till kärnan tillsätts en elektron för att kompensera för denna ökning av positiv laddning..
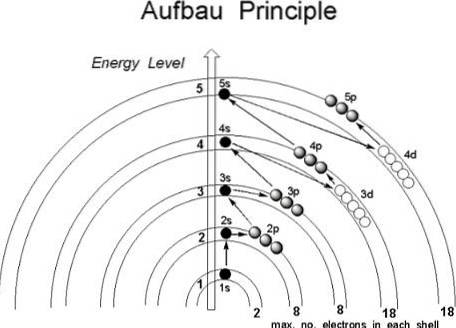
Även om det verkar som om protonerna inte följer en etablerad ordning för att gå med i atomens kärna, följer elektronerna en rad villkor, på ett sådant sätt att de först upptar atomområdena med lägre energi, särskilt de där sannolikheten för att hitta dem i rymden är större: orbitalerna.
Aufbau-principen, tillsammans med andra elektroniska fyllningsregler (Pauli-uteslutningsprincipen och Hunds regel), hjälper till att fastställa den ordning i vilken elektroner ska läggas till elektronmolnet; på detta sätt är det möjligt att tilldela en korrekt elektronisk konfiguration av ett visst kemiskt element.
Artikelindex
- 1 Koncept och förklaring
- 1.1 Skikt och underskikt
- 1.2 Paulis uteslutningsprincip och Hunds regel
- 2 Exempel
- 2.1 Kol
- 2.2 Syre
- 2.3 Kalcium
- 3 Begränsningar av Aufbau-principen
- 4 Referenser
Koncept och förklaring
Om atomen betraktades som om det var en lök, skulle ett begränsat antal lager hittas inom den, bestämd av huvudkvantantalet n.
Ytterligare, inuti dem, är subshells, vars former beror på kvantnummer azimuthal l och magnetisk m.
Orbitalerna identifieras av de tre första kvantnummer, medan den fjärde, snurrarna, hamnar som anger i vilken omlopp elektronen kommer att lokaliseras. Det är då i dessa delar av atomen där elektronerna roterar, från de innersta till de yttersta skikten: valensskiktet, det mest energiska av alla..
Detta är fallet, i vilken ordning ska elektronerna fylla orbitalerna? Enligt Aufbau-principen bör de tilldelas baserat på det ökande värdet (n + l).
På samma sätt måste elektronerna inom subshells (n + l) uppta subshell med det lägsta energivärdet; med andra ord upptar de det lägsta värdet av n.
Efter dessa konstruktionsregler utvecklade Madelung en visuell metod som består av att rita diagonala pilar, som hjälper till att bygga en atons elektroniska konfiguration. På vissa utbildningsområden kallas denna metod också som regnmetoden..
Lager och underskikt
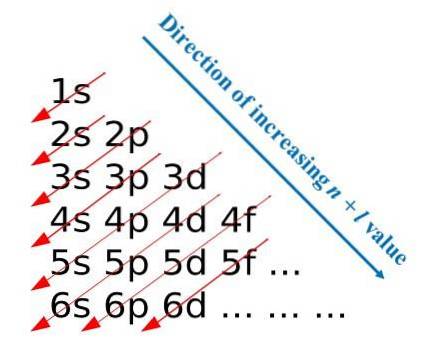
Den första bilden illustrerar en grafisk metod för att erhålla elektronkonfigurationerna, medan den andra bilden är respektive Madelung-metod. De mest energiska skikten ligger längst upp och de minst energiska är i en nedåtgående riktning..
Från vänster till höger transiteras underlagren s, p, d och f för deras motsvarande huvudenerginivåer. Hur beräknar man värdet på (n + l) för varje steg markerat med diagonala pilar? Till exempel, för 1s omlopp är denna beräkning lika med (1 + 0 = 1), för 2s omlopp (2 + 0 = 2) och för 3p omlopp (3 + 1 = 4).
Resultatet av dessa beräkningar kommer från bildens konstruktion. Om det därför inte finns tillgängligt, bestäm bara (n + l) för varje omloppsbana och börja fylla orbitalerna med elektroner från den med det lägsta värdet på (n + l) till den med det maximala värdet.
Användningen av Madelung-metoden underlättar dock konstruktionen av elektronkonfigurationen och gör den till en underhållande aktivitet för dem som lär sig det periodiska systemet..
Paulis uteslutningsprincip och Hunds regel
Madelung-metoden indikerar inte subshells orbitaler. Med hänsyn till dem säger Pauli-uteslutningsprincipen att ingen elektron kan ha samma kvanttal som en annan; eller vad är detsamma kan ett par elektroner inte ha både positiva eller negativa snurr.
Detta betyder att deras snurrkvanttal s inte kan vara lika och därför måste deras snurr kopplas ihop när de upptar samma omlopp.
Å andra sidan måste fyllningen av orbitalerna göras på ett sådant sätt att de försämras i energi (Hunds regel). Detta uppnås genom att hålla alla elektroner i orbitalerna oparade, tills det är absolut nödvändigt att para ihop ett par av dessa (som med syre).
Exempel
Följande exempel sammanfattar hela konceptet med Aufbau-principen..
Kol
För att bestämma dess elektroniska konfiguration måste atomnummer Z först vara känt, och därmed antalet elektroner. Kol har Z = 6, så dess 6 elektroner måste placeras i orbitalerna med Madelung-metoden:

Pilarna motsvarar elektronerna. Efter att ha fyllt orbitalerna 1 och 2, var och en med två elektroner, tilldelas 2p-orbitalerna med skillnad de återstående två elektronerna. Hunds regel manifesteras således: två degenererade orbitaler och en tom.
Syre

Syre har Z = 8, så det har två extra elektroner till skillnad från kol. En av dessa elektroner måste placeras i den tomma 2p-banan, och den andra måste paras för att bilda det första paret, med pilen nedåt. Följaktligen manifesteras här Pauli-uteslutningsprincipen.
Kalcium
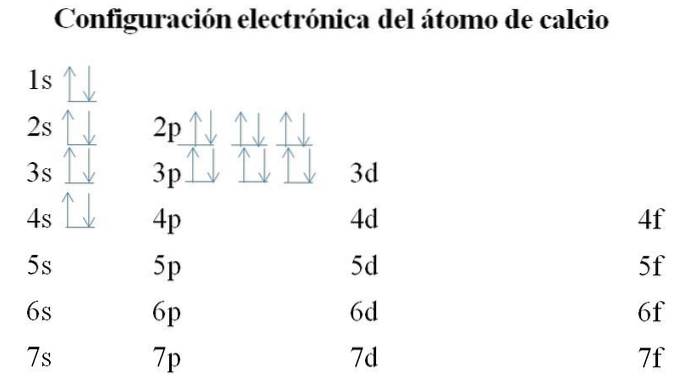
Kalcium har 20 elektroner och orbitalerna är fortfarande fyllda med samma metod. Fyllningsordningen är följande: 1s-2s-2p-3s-3p-4s.
Det kan noteras att i stället för att fylla 3d-banan först upptar elektronerna 4-talet. Detta inträffar innan man tar plats för övergångsmetaller, element som fyller det inre lagret 3d.
Begränsningar av Aufbau-principen
Aufbau-principen misslyckas med att förutsäga de elektroniska konfigurationerna för många övergångsmetaller och sällsynta jordartsmetaller (lantanider och aktinider).
Detta beror på att de energiska skillnaderna mellan ns och (n-1) d orbitaler är låga. Av skäl som stöds av kvantmekanik kan elektroner föredra att degenerera (n-1) d-orbitalerna på bekostnad av att ångra eller lossa elektroner från ns-banan.
Ett känt exempel är fallet med koppar. Dess elektronkonfiguration förutsagd av Aufbau-principen är 1stvå2stvå2 s63stvå3p64stvå3d9, när det experimentellt har visats vara 1stvå2stvå2 s63stvå3p64s13d10.
I den första är en ensam elektron oparad i en 3d-omlopp, medan den andra är alla elektroner i 3d-orbitalerna parade..
Referenser
- Helmenstine, Anne Marie, Ph.D. (15 juni 2017). Aufbau Princip Definition. Hämtad från: thoughtco.com
- Prof. N. De Leon. (2001). Aufbau-principen. Hämtad från: iun.edu
- Kemi 301. Aufbau-princip. Hämtad från: ch301.cm.utexas.edu
- Hozefa Arsiwala och teacherlookup.com. (1 juni 2017). Djupgående: Aufbau-princip med exempel. Hämtad från: teacherlookup.com
- Whitten, Davis, Peck & Stanley. Kemi. (8: e upplagan). CENGAGE Learning, s 199-203.
- Goodphy. (27 juli 2016). Schema för Madelung. [Figur]. Hämtad från: commons.wikimedia.org


Ingen har kommenterat den här artikeln än.