
Trippel punkt
Vad är den tredubbla punkten?
De trippel punkt är en term inom termodynamikfältet som hänvisar till temperaturen och trycket där tre faser av ett ämne existerar samtidigt i ett tillstånd av termodynamisk jämvikt. Denna punkt finns för alla ämnen, även om förhållandena under vilka de uppnås varierar enormt mellan varandra..
En trippelpunkt kan också involvera mer än en fas av samma typ för ett specifikt ämne; det vill säga två olika fasta, vätske- eller gasfaser observeras. Helium, i synnerhet dess isotop helium-4, är ett bra exempel på en trippelpunkt som involverar två individuella vätskefaser: normal vätska och superfluid..
Vad är det för och när används trippelpunkten?
Trippelpunkten för vatten används för att definiera kelvin, basenheten för termodynamisk temperatur i det internationella systemet för enheter (SI). Detta värde ställs in per definition snarare än uppmätt..
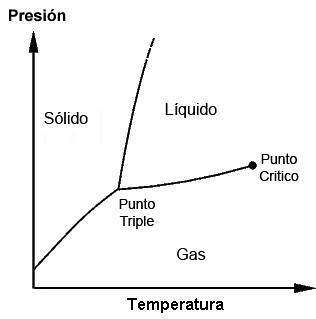
Trippelpunkterna för varje ämne kan observeras med hjälp av fasdiagram, som är ritade diagram som gör det möjligt att visa begränsningsförhållandena för en fast substans, flytande, gasformiga faser (och andra, i speciella fall) medan den utövas förändringar i temperatur, tryck och / eller löslighet.
Ett ämne kan hittas vid dess smältpunkt vid vilken fast ämne möter vätska; den kan också hittas vid sin kokpunkt där vätska möter gas. Det är dock vid den trefaldiga punkten att de tre faserna uppnås. Dessa diagram kommer att vara olika för varje ämne, vilket kommer att ses senare.
Trippelpunkt kan användas effektivt vid kalibrering av termometrar, med användning av trippelpunktsceller.
Dessa är prover av ämnen under isolerade förhållanden (inuti "glasceller") som befinner sig i sin tredubbla punkt med kända temperatur- och tryckförhållanden, och underlättar därmed studien av termometermätningens precision..
Studiet av detta koncept har också använts vid utforskningen av planeten Mars, där man försökte känna till havsnivån under uppdrag på 1970-talet..
Trippel punkt vatten

De exakta tryck- och temperaturförhållandena vid vilka vattnet samexisterar i dess tre faser i jämvikt - flytande vatten, is och ånga - uppträder vid en temperatur på exakt 273,16 K (0,01 ºC) och ett partiellt ångtryck på 611.656 pascal (0.00603659 atm).
Vid denna tidpunkt är omvandlingen av ämnet till någon av de tre faserna möjlig med minimala förändringar i dess temperatur eller tryck. Även om systemets totala tryck kan vara över det som krävs för trippelpunkten, kommer ångpartiets tryck på 611 656 Pa att nå trippelpunkten på samma sätt..
Det är möjligt att observera i den föregående figuren representationen av trippelpunkten (eller trippel punkt, på engelska) av ett ämne vars diagram liknar det för vatten, beroende på temperatur och tryck som krävs för att nå detta värde.
När det gäller vatten motsvarar denna punkt det minsta tryck vid vilket flytande vatten kan existera. Vid tryck mindre än denna tredubbla punkt (till exempel i vakuum) och när konstant tryckuppvärmning används kommer fast is att omvandlas direkt till vattenånga utan att passera genom vätska; detta är en process som kallas sublimering.
Utöver detta minimitryck (Ptp) smälter isen först för att bilda flytande vatten och först därefter kommer den att avdunsta eller koka för att bilda ånga.
För många ämnen är temperaturvärdet vid sin tredubbla punkt den lägsta temperatur vid vilken vätskefasen kan existera, men detta händer inte när det gäller vatten. För vatten händer detta inte, eftersom isens smältpunkt minskar som en funktion av trycket, vilket visas av den gröna prickade linjen i föregående figur..
I högtrycksfaser har vattnet ett ganska komplext fasdiagram, där femton kända isfaser visas (vid olika temperaturer och tryck), förutom tio olika trippelpunkter som visualiseras i följande figur:
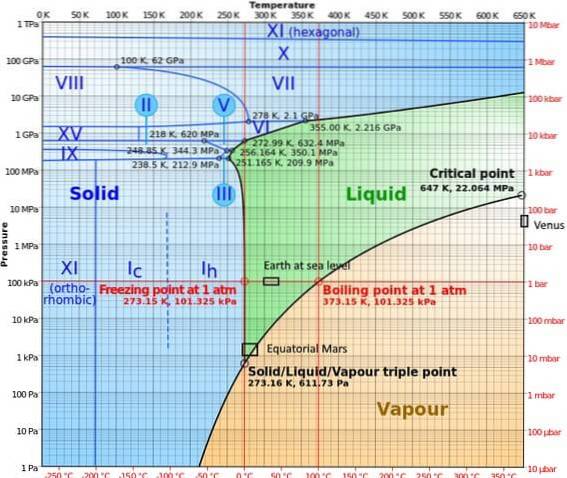
Det kan noteras att is under högtrycksförhållanden kan finnas is i jämvikt med vätskan; diagrammet visar att smältpunkter ökar med trycket. Vid konstant låga temperaturer och ökande tryck kan ångan omvandlas direkt till is utan att passera genom vätskefasen..
De olika förhållandena som förekommer på planeterna där tredubbelpunkten har studerats (jorden vid havsnivå och i Mars ekvatorialzon) representeras också i detta diagram..
Diagrammet gör det tydligt att trippelpunkten varierar beroende på plats på grund av atmosfärstryck och temperatur, och inte bara på grund av experimentets ingripande..
Cyklohexan trippelpunkt
Cyklohexan är en cykloalkan som har molekylformeln C6H12. Detta ämne har den egenskapen att ha trepunktsförhållanden som lätt kan reproduceras, som i fallet med vatten, eftersom denna punkt ligger vid en temperatur av 279,47 K och ett tryck av 5,388 kPa.
Under dessa betingelser har föreningen observerats koka, stelna och smälta med minimala förändringar i temperatur och tryck..
Bensen trippelpunkt
I ett fall som liknar cyklohexan, bensen (en organisk förening med den kemiska formeln C6H6) har trepunktsförhållanden som lätt kan reproduceras i ett laboratorium.
Dess värden är 278,5 K och 4,83 kPa, så experiment med denna komponent på nybörjarnivå är också vanligt..
Referenser
- Wikipedia. (s.f.). Wikipedia. Hämtad från en.wikipedia.org
- Britannica, E. (1998). Encyclopedia Britannica. Hämtad från britannica.com
- Ström, N. (s.f.). Kärnkraft. Hämtad från nuclear-power.net
- Wagner, W., Saul, A., & Prub, A. (1992). Internationella ekvationer för trycket längs smältningen och längs sublimeringskurvan för vanligt vatten. Bochum.
- Penoncello, S. G., Jacobsen, R. T. och Goodwin, A. R. (1995). En termodynamisk egenskaper för cyklohexan.



Ingen har kommenterat den här artikeln än.