
Vad är reaktionsvärmen?

De reaktionsvärme eller Enthalpy of Reaction (ΔH) är förändringen i entalpi av en kemisk reaktion som sker vid konstant tryck. Det är en termodynamisk måttenhet som är användbar för att beräkna mängden energi per mol som frigörs eller produceras i en reaktion.
Eftersom entalpi härrör från tryck, volym och inre energi, som alla är tillståndsfunktioner, är entalpi också en tillståndsfunktion..
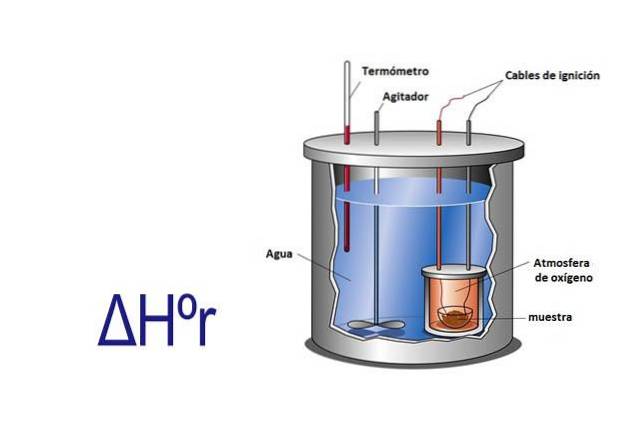
ΔH, eller entalpiförändringen, uppstod som en måttenhet som var avsedd att beräkna energisförändringen i ett system när det blev för svårt att hitta ΔU, eller förändring i ett inre energi i ett system, samtidigt som mätning av mängden värme och arbete utbytt.
Med ett konstant tryck är entalpiändringen lika med värme och kan mätas som ΔH = q.
Beteckningen ΔHº eller ΔHºr uppstår sedan för att förklara den exakta temperaturen och trycket för reaktionsvärmen ΔH.
Standardenthalpin för reaktionen symboliseras av ΔHº eller ΔHºrxn och kan anta både positiva och negativa värden. Enheterna för ΔHº är kiloJoules per mol eller kj / mol.
Tidigare koncept för att förstå reaktionsvärmen: skillnader mellan ΔH och ΔHºr.
Δ = representerar förändringen i entalpi (entalpi av produkter minus entalpi av reaktanter).
Ett positivt värde indikerar att produkterna har högre entalpi eller att det är en endoterm reaktion (värme krävs).
Ett negativt värde indikerar att reaktanterna har högre entalpi eller att det är en exoterm reaktion (värme produceras).
º = betyder att reaktionen är en vanlig entalpiändring och sker vid ett förinställt tryck / temperatur.
r = betecknar att denna förändring är reaktionens entalpi.
Standardtillståndet: standardtillståndet för ett fast ämne eller en vätska är den rena substansen vid ett tryck på 1 bar eller vad som är samma 1 atmosfär (105 Pa) och en temperatur på 25 ° C, eller vad är samma 298 K.
ΔHºr är standard reaktionsvärme eller standard entalpi av en reaktion, och som Ah mäter den också reaktionens entalpi. Emellertid sker ΔHºrxn under "standard" -förhållanden, vilket innebär att reaktionen äger rum vid 25 ° C och 1 atm..
Fördelen med en ΔH-mätning under standardförhållanden ligger i förmågan att relatera ett ΔHº-värde till ett annat, eftersom de förekommer under samma förhållanden.
Bildningsvärme
Standardbildningsvärmen, ΔHFº, av en kemisk produkt är mängden värme som absorberas eller frigörs från bildandet av 1 mol av kemikalien vid 25 grader Celsius och 1 bar av dess element i deras standardtillstånd.
Ett element är i sitt standardläge om det är i sin mest stabila form och i sitt fysiska tillstånd (fast, flytande eller gas) vid 25 grader Celsius och 1 bar.
Till exempel involverar standardbildningsvärmen för koldioxid syre och kol som reaktanter..
Syre är mer stabil som O-gasmolekylertvå, medan kol är mer stabil som fast grafit. (Grafit är stabilare än diamant under standardförhållanden).
För att uttrycka definitionen på ett annat sätt är standardbildningsvärmen en speciell typ av standardreaktionsvärme..
Reaktionen är bildandet av 1 mol av en kemikalie från dess grundämnen i deras standardtillstånd under standardförhållanden.
Standardformationsvärmen kallas också standard entalpi för formation (även om det faktiskt är en förändring i entalpi).
Per definition skulle bildandet av ett element i sig inte ge någon förändring i entalpi, så standardreaktionsvärmen för alla element är noll (Cai, 2014).
Beräkning av reaktionens entalpi
1- Experimentell beräkning
Enthalpi kan mätas experimentellt med hjälp av en kalorimeter. En kalorimeter är ett instrument där ett prov reageras genom elektriska kablar som ger aktiveringsenergin. Provet finns i en behållare omgiven av vatten som hela tiden omrörs.
Genom att mäta den temperaturförändring som inträffar när provet reagerar, och känna till den specifika värmen av vatten och dess massa, beräknas värmen som frigörs eller absorberas av reaktionen med hjälp av ekvationen q = Cesp x m x ΔT.
I denna ekvation är q värme, Cesp är den specifika värmen i detta fall av vatten som är lika med 1 kalori per gram, m är vattenmassan och AT är temperaturförändringen.
Kalorimetern är ett isolerat system som har ett konstant tryck, så ΔHr= q
2- Teoretisk beräkning
Enhalpiförändringen beror inte på den specifika reaktionsvägen, utan bara på produkternas och reaktanternas globala energinivå. Entalpi är en funktion av tillståndet och som sådan är den additiv.
För att beräkna standardenthalpin för en reaktion kan vi addera standardenthalpierna för bildning av reaktanterna och subtrahera den från summan av standardenthalpierna för bildning av produkterna (Boundless, S.F.). Angivet matematiskt ger detta oss:
Ahr° = Σ AHFº (produkter) - Σ ΔHFº (reaktanter).
Enthalpier av reaktioner beräknas vanligtvis från entalpier av reaktantbildning under normala förhållanden (tryck på 1 bar och temperatur 25 grader Celsius).
För att förklara denna termodynamikprincip beräknar vi reaktionens entalpi för förbränning av metan (CH4enligt formeln:
CH4 (g) + 20två (g) → COtvå (g) + 2HtvåO (g)
För att beräkna standardenthalpin för reaktionen måste vi hitta standardenthalpierna för bildning för var och en av reaktanterna och produkterna som är inblandade i reaktionen..
Dessa finns vanligtvis i en bilaga eller i olika tabeller online. För denna reaktion är de uppgifter vi behöver:
HFº CH4 (g) = -75 kjoul / mol.
HFº Otvå (g) = 0 kjoul / mol.
HFº COtvå (g) = -394 kjoul / mol.
HFº HtvåO (g) = -284 kjoul / mol.
Observera att eftersom det är i sitt standardläge är standard entalpi för bildning av syrgas 0 kJ / mol.
Här sammanfattar vi våra standardbildande entalpier. Observera att eftersom enheterna är i kJ / mol, måste vi multiplicera med de stökiometriska koefficienterna i den balanserade reaktionsekvationen (Leaf Group Ltd, S.F.).
Σ ΔHFº (produkter) = ΔHFº COtvå +2 AhFº HtvåELLER
Σ ΔHFº (produkter) = -1 (394 kjoul / mol) -2 (284 kjoul / mol) = -962 kjoul / mol
Σ ΔHFº (reaktanter) = ΔHFº CH4 + AhFº Otvå
Σ ΔHFº (reaktanter) = -75 kjoul / mol + 2 (0 kjoul / mol) = -75 kjoul / mol
Nu kan vi hitta reaktionens standardentalpi:
Ahr° = ΔHFº (produkter) - Σ ΔHFº (reaktanter) = (- 962) - (- 75) =
Ahr° = - 887 kJ / mol.
Referenser
- Anne Marie Helmenstine. (2014, 11 juni). Enthalpy of Reaction Definition. Återställd från thoughtco: thoughtco.com.
- (S.F.). Standard reaktionsentalpi. Återställd från gränslös: boundless.com.
- Cai, E. (2014, 11 mars). standardbildningsvärme. Återställd från kemikaliestatist: chemicalstatistician.wordpress.com.
- Clark, J. (2013, maj). Olika definitioner av entalpiändringar. Återställd från chemguide.co.uk: chemguide.co.uk.
- Jonathan Nguyen, G. L. (2017, 9 februari). Standard Enthalpy of Formation. Återställd från chem.libretexts.org: chem.libretexts.org.
- Leaf Group Ltd. (S.F.). Hur man beräknar reaktionsentalpier. Återställd från sciencing: sciencing.com.
- Rachel Martin, E. Y. (2014, 7 maj). Reaktionsvärme. Återställd från chem.libretexts.org: chem.libretexts.org.


Ingen har kommenterat den här artikeln än.