
Vad är spektral notation?
De spektral notation är arrangemanget av elektroner i energinivåer runt en atoms kärna. Enligt den gamla Bohr-atommodellen upptar elektroner olika nivåer i banor runt kärnan, från det första skalet närmast kärnan, K, till det sjunde skalet, Q, som är längst bort från kärnan..
När det gäller en mer förfinad kvantmekanisk modell är K-Q-skalen uppdelade i en uppsättning orbitaler, som var och en kan upptas av högst ett elektronpar..

Vanligtvis används elektronkonfigurationen för att beskriva en atoms orbitaler i dess jordtillstånd, men den kan också användas för att representera en atom som har joniserats till en katjon eller anjon, vilket kompenserar för förlust eller förstärkning av elektroner i deras respektive orbitaler. ..
Många av de fysiska och kemiska egenskaperna hos element kan korreleras med deras unika elektroniska konfigurationer. Valenselektroner, elektronerna i det yttersta skalet, är den avgörande faktorn för elementets unika kemi..
När elektroner i atomens yttersta skal får energi av något slag flyttar de sig till högre energilager. Således kommer en elektron i K-skalet att överföras till L-skalet i ett tillstånd med högre energi.
När elektronen återgår till sitt jordtillstånd frigör den den energi den absorberas genom att avge ett elektromagnetiskt spektrum (ljus). Eftersom varje atom har en specifik elektronisk konfiguration kommer den också att ha ett specifikt spektrum som kommer att kallas absorptionsspektrumet (eller emissionsspektrumet)..
Av denna anledning används termen spektral notation för att hänvisa till elektronkonfigurationen.
Hur man bestämmer spektralnotation: kvantnummer
Totalt fyra kvantnummer används för att fullständigt beskriva rörelsen och banorna för varje elektron i en atom..
Kombinationen av alla kvantnummer för alla elektroner i en atom beskrivs av en vågfunktion som uppfyller Schrödinger-ekvationen. Varje elektron i en atom har en unik uppsättning kvantnummer.
Enligt Pauli-uteslutningsprincipen kan två elektroner inte dela samma kombination av fyra kvantnummer.
Kvantnummer är viktiga eftersom de kan användas för att bestämma elektronens konfiguration för en atom och den troliga platsen för elektronerna i atomen..
Kvantnummer används också för att bestämma andra egenskaper hos atomer, såsom joniseringsenergi och atomradie..
Kvantnummer betecknar specifika skal, delskal, orbitaler och elektronsnurr.
Detta betyder att de fullständigt beskriver egenskaperna hos en elektron i en atom, det vill säga de beskriver varje unik lösning på Schrödinger-ekvationen, eller vågfunktionen, av elektroner i en atom..
Det finns totalt fyra kvantnummer: huvudkvantantalet (n), det orbitala vinkelmomentkvantantalet (l), det magnetiska kvantantalet (ml) och elektronsnurrkvantantalet (ms).
Huvudkvantantalet, nn, beskriver energin hos en elektron och det mest troliga avståndet mellan elektronen och kärnan. Med andra ord hänvisar det till storleken på banan och energinivån vid vilken en elektron är placerad..
Antalet subshells, eller ll, beskriver banans form. Den kan också användas för att bestämma antalet vinkelnoder.
Det magnetiska kvantantalet, ml, beskriver energinivåerna i en subshell, och ms hänvisar till rotationen på elektronen, som kan vara upp eller ner..
Aufbau-principen
Aufbau kommer från det tyska ordet "Aufbauen" som betyder "att bygga". I grund och botten, genom att skriva elektronkonfigurationer bygger vi elektronorbitaler när vi rör oss från en atom till en annan..
När vi skriver elektronens konfiguration för en atom kommer vi att fylla i orbitalerna i ökande ordning med atomnummer.
Aufbau-principen härstammar från Pauli-uteslutningsprincipen som säger att det inte finns två fermioner (t.ex. elektroner) i en atom.
De kan ha samma uppsättning kvantnummer, så de måste "stapla" vid högre energinivåer. Hur elektroner ackumuleras är en fråga om elektronkonfigurationer.
Stabila atomer har lika många elektroner som protoner har i kärnan. Elektroner samlas runt kärnan i kvantorbitaler enligt fyra grundläggande regler som kallas Aufbau-principen..
- Det finns inga två elektroner i atomen som delar samma fyra kvantnummer n, l, m och s.
- Elektroner kommer att inta de lägsta orbitalerna på energinivå först.
- Elektronerna kommer alltid att fylla orbitalerna med samma centrifugeringsnummer. När orbitalerna är fulla börjar det.
- Elektronerna kommer att fylla orbitaler med summan av kvantnummer n och l. Orbitaler med lika värden på (n + l) fylls först med de lägre n-värdena.
Den andra och fjärde reglerna är i princip samma. Ett exempel på regel fyra skulle vara orbitalerna 2p och 3s.
En 2p-omlopp är n = 2 och l = 2 och en 3s-omlopp är n = 3 och l = 1. (N + l) = 4 i båda fallen, men 2p-omloppet har lägst energi eller lägsta n-värde och fyll före lagret 3s.
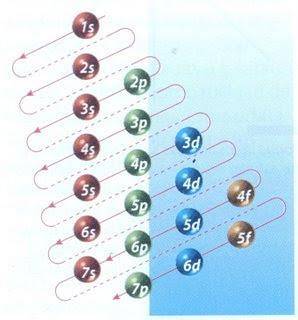
Lyckligtvis kan Moeller-diagrammet som visas i figur 2 användas för att fylla elektron. Grafen läses genom att köra diagonalerna från 1s.
Figur 2 visar atomorbitalerna och pilarna följer vägen framåt.
Nu när orbitalens ordning är känd för att fyllas är det enda kvar att memorera storleken på varje omlopp.
S-orbitaler har ett möjligt värde på ml för att hålla 2 elektroner
P-orbitaler har 3 möjliga värden på ml för att hålla 6 elektroner
D-orbitaler har 5 möjliga värden på ml för att hålla 10 elektroner
F-orbitaler har 7 möjliga värden på ml för att rymma 14 elektroner
Detta är allt som behövs för att bestämma den elektroniska konfigurationen av en stabil atom av ett element..
Ta till exempel grundämnet kväve. Kväve har sju protoner och därför sju elektroner. Den första banan som fylls är 1-banan. En s orbital har två elektroner, så det finns fem elektroner kvar.
Nästa orbital är 2s orbital och innehåller de två nästa. De sista tre elektronerna går till 2p-banan som rymmer upp till sex elektroner.
Hund reglerar
Aufbau's avsnitt diskuterade hur elektroner först fyller orbitaler med lägst energi och sedan går upp till orbitaler med högst energi först efter att orbitaler med lägst energi har fyllts..
Det finns dock ett problem med denna regel. Visst måste 1s-orbitalerna fyllas före 2s-orbitalerna, eftersom 1s-orbitalerna har ett lägre värde på n och därmed en lägre energi..
Och de tre olika 2p-orbitalerna? I vilken ordning ska de fyllas? Svaret på denna fråga handlar om Hunds regel.
Hunds regel säger att:
- Varje orbital i ett undernivå är ockuperat innan någon orbital är dubbelt upptagen.
- Alla elektroner i individuellt ockuperade orbitaler har samma snurrning (för att maximera total snurrning).
När elektroner tilldelas orbitaler försöker en elektron först att fylla alla orbitaler med liknande energi (även kallad degenererade orbitaler) innan de kopplas ihop med en annan elektron i en halvfull orbital..
Atomer i marktillstånd tenderar att ha så många oparade elektroner som möjligt. När du visualiserar denna process, överväga hur elektroner uppvisar samma beteende som samma poler i en magnet om de skulle komma i kontakt..
När negativt laddade elektroner fyller orbitalerna försöker de först komma så långt bort från varandra som möjligt innan de måste kopplas ihop..
Referenser
- Anastasiya Kamenko, T. E. (2017, 24 mars). Kvantnummer. Återställd från chem.libretexts.org.
- Aufbau-principen. (2015, 3 juni). Återställd från chem.libretexts.org.
- Elektronkonfigurationer och egenskaperna hos atomer. (S.F.). Återställd från oneonta.edu.
- Encyclopædia Britannica. (2011, 7 september). Elektronisk konfiguration. Återställd från britannica.com.
- Helmenstine, T. (2017, 7 mars). Aufbau-principen - elektronisk struktur och Aufbau-principen. Återställd från thoughtco.com.
- Hunds regler. (2015, 18 juli). Återställd från chem.libretexts.org.
- Spektroskopisk notation. (S.F.). Återställd från bcs.whfreeman.com.


Ingen har kommenterat den här artikeln än.