
Vad är Van der Waals styrkor?
De Van der Waals styrkor de är intermolekylära krafter av elektrisk natur som kan vara attraktiva eller frånstötande. Det finns en interaktion mellan ytorna på molekylerna eller atomerna, skiljer sig i huvudsak från de joniska, kovalenta och metalliska bindningarna som bildas inuti molekylerna..
Även om dessa krafter är svaga kan de locka till sig gasmolekyler; även för flytande och stelnade gaser och för alla organiska vätskor och fasta ämnen. Johannes Van der Waals (1873) var den som utvecklade en teori för att förklara verkliga gasers beteende.

I den så kallade Van der Waals-ekvationen för riktiga gaser - (P + tillntvå/ Vtvå) (V - nb)) = nRT - två konstanter införs: konstanten b (dvs volymen upptagen av gasmolekylerna) och “a”, som är en empirisk konstant.
Konstanten "a" korrigerar avvikelsen från det förväntade beteendet hos idealgaser vid låga temperaturer, precis där dragkraften mellan gasmolekylerna uttrycks. En atoms förmåga att polarisera i det periodiska systemet ökar från toppen av en grupp till gruppens botten och från höger till vänster under en period..
Genom att öka atomantalet - och därmed antalet elektroner - är de som ligger i de yttre skalen lättare att flytta för att bilda polära element.
Artikelindex
- 1 Intermolekylära elektriska interaktioner
- 1.1 Interaktion mellan permanenta dipoler
- 1.2 Interaktion mellan en permanent dipol och en inducerad dipol
- 2 Londons styrkor eller spridning
- 3 Van der Waals-radioer
- 4 Krafter och energi i den elektriska interaktionen mellan atomer och mellan molekyler
- 5 Referenser
Intermolekylära elektriska interaktioner
Interaktion mellan permanenta dipoler
Det finns elektriskt neutrala molekyler, vilka är permanenta dipoler. Detta beror på en störning i den elektroniska fördelningen som producerar en rumslig separation av de positiva och negativa laddningarna mot ändarna av molekylen, vilket utgör en dipol (som om det vore en magnet).
Vatten består av två väteatomer i ena änden av molekylen och en syreatom i den andra änden. Syre har en högre affinitet för elektroner än väte och lockar dem.
Detta ger en förskjutning av elektroner mot syre, vilket lämnar detta negativt laddade och väte med en positiv laddning..

Den negativa laddningen hos en vattenmolekyl kan interagera elektrostatiskt med den positiva laddningen hos en annan vattenmolekyl som orsakar en elektrisk attraktion. Således kallas denna typ av elektrostatisk interaktion Keesom-krafter.
Interaktion mellan en permanent dipol och en inducerad dipol
Den permanenta dipolen har det som kallas ett dipolmoment (µ). Dipolmomentets storlek ges av det matematiska uttrycket:
^ = q.x
q = elektrisk laddning.
x = rumsligt avstånd mellan polerna.
Dipolmomentet är en vektor som enligt konvention representeras orienterad från den negativa polen till den positiva polen. Storleken på µ gör ont i uttryck (3,34 × 10-30 Centimeter.
Den permanenta dipolen kan interagera med en neutral molekyl som orsakar en förändring i dess elektroniska distribution, vilket resulterar i en inducerad dipol i denna molekyl.
Den permanenta dipolen och den inducerade dipolen kan interagera elektriskt och producera en elektrisk kraft. Denna typ av interaktion kallas induktion och de krafter som verkar på den kallas Debye-krafter..
Londons styrkor eller spridning
Dessa attraktiva krafters natur förklaras av kvantmekanik. London postulerade att i ett ögonblick, i elektriska neutrala molekyler, kanske inte centrumet för elektronernas negativa laddningar och centrumet för de positiva laddningarna av kärnorna sammanfaller..
Så fluktueringen av elektrontätheten gör att molekylerna kan bete sig som tillfälliga dipoler.
Detta är inte i sig en förklaring till attraktiva krafter, men tillfälliga dipoler kan inducera korrekt inriktad polarisering av intilliggande molekyler, vilket resulterar i alstring av en attraktiv kraft. De attraktiva krafterna som genereras av elektroniska fluktuationer kallas Londons styrkor eller dispersion..
Van der Waals krafter visar anisotropi, varför de påverkas av molekylernas orientering. Emellertid är interaktioner av dispersionstyp övervägande attraktiva..
Londons krafter blir starkare när storleken på molekylerna eller atomerna ökar.
I halogener, F-molekylernatvå och Cltvå låga atomantal är gaser. BRtvå med det högsta atomnummeret är en vätska och jagtvå, halogen med högst atomnummer är ett fast ämne vid rumstemperatur.
Att öka atomantalet ökar antalet elektroner som är närvarande, vilket underlättar polariseringen av atomerna och därför interaktionen mellan dem. Detta bestämmer halogenernas fysiska tillstånd.
Van der Waals radio
Interaktionerna mellan molekyler och mellan atomer kan vara attraktiva eller frånstötande, beroende på ett kritiskt avstånd mellan deras centra, vilket kallas rv.
Vid avstånd mellan molekyler eller atomer större än rv, attraktionen mellan kärnorna i en molekyl och elektronerna i den andra dominerar över avstötningarna mellan kärnorna och elektronerna i de två molekylerna.
I det beskrivna fallet är interaktionen attraktiv, men vad händer om molekylerna närmar sig på ett avstånd mellan sina centra som är mindre än rv? Då dominerar den motbjudande kraften över den attraktiva, som motsätter sig en närmare inställning mellan atomerna..
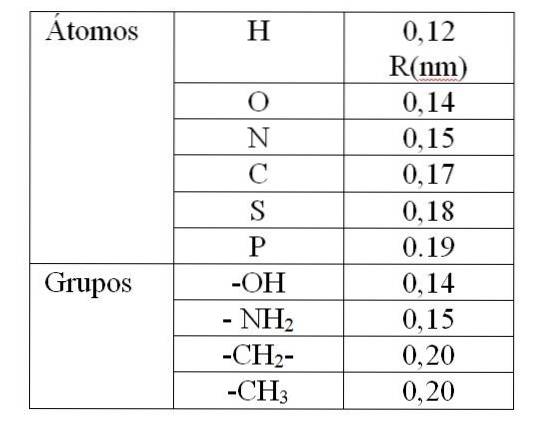
Värdet på rv Den ges av de så kallade Van der Waals-radierna (R). För sfäriska och identiska molekyler rv är lika med 2R. För två olika molekyler med radier R1 och Rtvå: rv är lika med R1 + Rtvå. Värdena för Van der Waals-radier ges i tabell 1.
Värdet i tabell 1 indikerar en Van der Waals-radie på 0,12 nm (10-9 m) för väte. Då värdet av rv för denna atom är den 0,24 nm. För ett värde av rv mindre än 0,24 nm producerar en avstötning mellan väteatomerna.
Krafter och energi i den elektriska interaktionen mellan atomer och mellan molekyler
Kraften mellan ett par laddningar q1 och vadtvå, separerade i vakuum av avståndet r, ges av Coulombs lag.
F = k. Vad1.Vadtvå/ rtvå
I detta uttryck är k en konstant vars värde beror på de använda enheterna. Om kraftens värde - givet genom tillämpningen av Coulombs lag - är negativt, indikerar det en attraktiv kraft. Tvärtom, om det värde som ges för kraften är positivt, är det en indikation på en avstötande kraft.
Eftersom molekylerna vanligtvis finns i ett vattenhaltigt medium som skyddar de utövade elektriska krafterna är det nödvändigt att införa termen dielektrisk konstant (ε). Således korrigerar denna konstant det värde som ges för de elektriska krafterna genom tillämpningen av Coulombs lag.
F = k.q1.Vadtvå/ε.rtvå
På samma sätt ges energin för den elektriska interaktionen (U) genom uttrycket:
U = k. Vad1.Vadtvå/ε.r
Referenser
- Redaktörerna för Encyclopaedia Britannica. (2018). Van der Waals styrkor. Hämtad den 27 maj 2018 från: britannica.com
- Wikipedia. (2017). Van der Waals styrkor. Hämtad den 27 maj 2018 från: es.wikipedia.org
- Kathryn Rashe, Lisa Peterson, Seila Buth, Irene Ly. Van der waals styrkor. Hämtad den 27 maj 2018 från: chem.libretexts.org
- Morris, J. G. (1974) En biologs fysikaliska kemi. 2 och upplaga. Edward Arnold (Publishers) Limited.
- Mathews, C. K., Van Holde, K.E. och Ahern, K.G. (2002) Biokemi. Tredje upplagan. Addison Wesley Longman, Inc..



Ingen har kommenterat den här artikeln än.