
Vad är Döbereiner-triader?

De Döbereiner triader De är grupper om tre kemiska element som har liknande egenskaper. De är en del av de 118 kemiska elementen, eftersom de är de olika reaktionerna som visas och deras föreningar, deras mest fascinerande aspekt.
Tanken med att klassificera grundämnena är att behandla deras kemiska egenskaper på ett adekvat sätt utan att behöva utveckla en uppsättning regler och teorier för var och en av dem isolerat..
Deras periodiska klassificering har gett en oerhört användbar systematisk ram för att korrelera dem enligt några mycket enkla och logiska mönster..
Elementen är systematiskt ordnade i rader och kolumner med ökande atomnummer, och utrymme har reserverats för nya upptäckter..
År 1815 var endast cirka 30 artiklar kända. Även om det fanns mycket information tillgänglig om dessa och deras föreningar fanns det ingen uppenbar ordning.
Flera försök gjordes för att hitta ordern, men det var svårt att organisera allt som var känt, så många forskare började leta efter något mönster i dess egenskaper som skulle göra det möjligt att avhjälpa denna situation..
Upptäckten av Döbereiner-triaderna
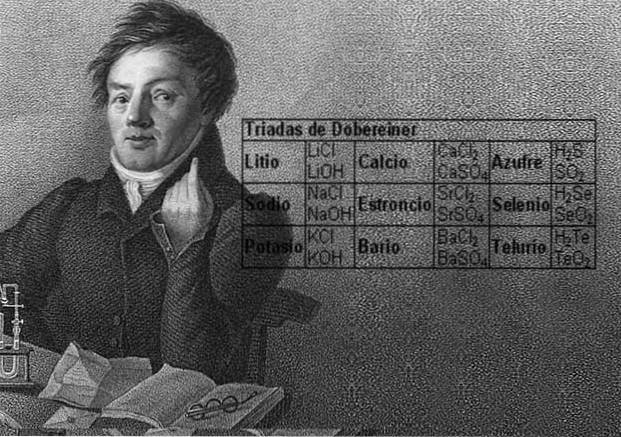
Vetenskapsmannen Johann Wolfgang Döbereiner gjorde viktiga resultat om den numeriska regelbundenheten mellan elementens atomvikt, han var den första som märkte förekomsten av flera grupper om tre element, som han kallade triader, som visade kemiska likheter.
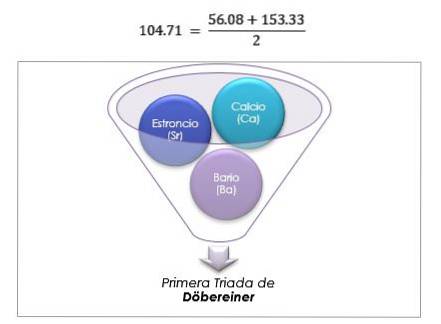
Dessa element avslöjade ett viktigt numeriskt förhållande, eftersom en gång ordnat efter deras motsvarande vikt eller atomvikt, visade sig det centrala elementets vikt vara det ungefärliga genomsnittet av de två återstående elementen i triaden..
1817 fann Döbereiner att om vissa element kombinerades med syre i binära föreningar, kunde ett numeriskt samband urskiljas mellan motsvarande vikter för dessa föreningar..
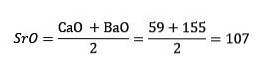
Döbereinerns observation hade först liten inverkan på den kemiska världen men blev senare mycket inflytelserik. Idag anses han vara en av pionjärerna i utvecklingen av det periodiska systemet..
Tolv år senare, 1829, lade Döbereiner till tre nya triader, som visas nedan:
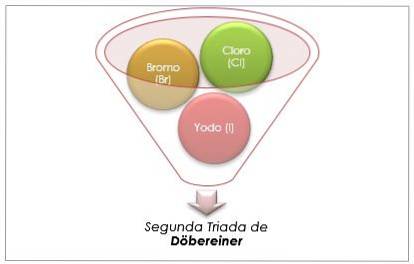
Halogengrupp
Klor, brom och jod har liknande kemiska egenskaper och bildar en triad. Dessa element är mycket reaktiva icke-metaller. Om de listas i ordning efter ökande relativ massa är de i ordning efter minskande reaktivitet. Brom har en mellanliggande atommassa mellan klor och jod.

Atommassan för mediumelementet Brom (Br) är lika med medelvärdet av atommassorna av klor (Cl) och jod (I).
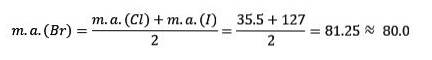
Det erhållna medelvärdet ligger nära atommassan för brom (Br).
Likheter i kemiska egenskaper:
- De är alla icke-metaller.
- De reagerar alla med vatten för att bilda syror (till exempel i: HCl, HBr, HF).
- De har alla en valens på en (till exempel i: HCl, HBr, HF).
- Alla reagerar med alkalimetaller för att bilda neutrala salter (t.ex. NaCl, NaBr, NaI)
Alkali metallgrupp
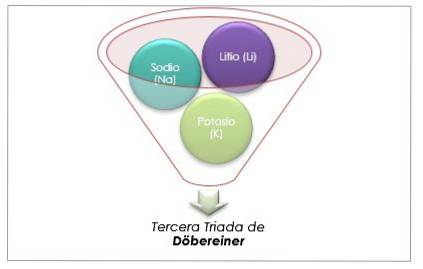
Litium, natrium och kalium har liknande kemiska egenskaper och bildar en triad. Dessa element är mjuka och lätta metaller men mycket reaktiva..
Om de listas i ordning efter ökande relativ atommassa, är de också i ordning för ökande reaktivitet. Natrium har den mellanliggande atommassan mellan litium och kalium.

Atommassan för det centrala elementet Sodium (Na) är lika med genomsnittet av atommassan för Litium (Li) och Kalium (K).
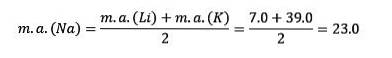
Likheter i kemiska egenskaper:
- De är alla metaller.
- De reagerar alla med vatten för att bilda alkaliska lösningar och vätgas..
- De har alla en valens på en (till exempel i: LiCl, NaCl, KCl).
- Dess karbonater är resistenta mot termisk nedbrytning.
Grupp av kalkogener eller amfigener
Svavel, selen och tellur har liknande kemiska egenskaper och bildar en triad. Selen har den mellanliggande atommassan mellan svavel och tellur.

Atommassan för mellersta elementet Selen (Se) är lika med de genomsnittliga atommassorna för svavel (S) och Tellurium (Te).
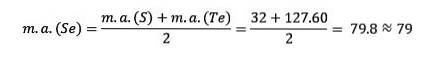
Återigen är det genomsnittliga erhållna värdet nära atommassan för Selen (Se).
Likheter i kemiska egenskaper:
- Vätekombinationer av dessa element resulterar i giftiga gaser.
- Var och en av dessa element har 6 valenselektroner.
- Metalliska egenskaper ökar när atomantalet ökar.

Döbereiner noterade också att triader måste avslöja kemiska förhållanden mellan elementen såväl som numeriska förhållanden för att vara giltiga..
Å andra sidan vägrade han att gruppera fluor tillsammans med klor, brom och jod, som han kunde ha gjort av kemiska skäl, eftersom han inte hittade ett triadförhållande mellan atomvikterna för fluor och de andra halogenerna..
Han var också ovillig att överväga utseendet på triader mellan olika element, såsom kväve, kol och syre, trots att de visade ett signifikant triadiskt numeriskt förhållande.
Dobereiners arbete fokuserade på relationerna mellan elementen i en triad, men gav inga ledtrådar om förhållandet mellan triaderna..
Det räcker med att säga att Döbereiners forskning etablerade begreppet triader som ett kraftfullt begrepp, som flera andra kemister snart skulle ta hänsyn till..
Faktum är att Döbereiner-triaderna representerade det första steget att gruppera elementen i vertikala kolumner inom det periodiska systemet och på detta sätt skapa ett system som förklarar de kemiska egenskaperna och avslöjar de fysiska förhållandena mellan elementen..
Förlängning av triaderna
Andra kemister utvidgade Döbereiner-triaderna till att omfatta mer än de tre ursprungliga elementen. Till exempel tillsattes fluor till toppen av triaden innehållande klor, brom och jod..
Andra "triader" producerades, såsom en som innehöll syre, svavel, selen och tellur. Men det fanns inget system som korrelerade dem som en helhet.
En av de största nackdelarna var att många relativa atommassor fortfarande hade fel för tiden..
Referenser
- Clugston, M. och Flemming, R. (2000). Avancerad kemi. New York, Oxford University Press.
- Johann Wolfgang Döbereiner. Återställd från: britannica.com.
- Sauders, N. (2010). Genombrott inom vetenskap och teknik: Vem uppfann det periodiska systemet?. Minnesotta, Arcturus Publishing Limited.
- Scerri, E. (2007). Det periodiska systemet: dess berättelse och dess betydelse. New York, Oxford University Press.
- Shyamal, A. (2008). Living Science Chemistry 10. New Delhi, Ratna Sagar P. Ltd..
- Vad är grupp 16 i det periodiska systemet? Hur används dessa element? Återställd från: quora.com.



Ingen har kommenterat den här artikeln än.