
Vad är energidelenivåer och hur representeras de?

De energinivåer i atomen är de det sätt på vilket elektronerna är organiserade i de elektroniska skalen, deras fördelning i molekylen eller atomen. Dessa energinivåer kallas orbitaler..
Organiseringen av elektroner i undernivåer är det som tillåter kemiska kombinationer av olika atomer och definierar också deras position inom det periodiska systemet..
Elektroner är ordnade i atomens elektroniska skal på ett visst sätt genom en kombination av kvanttillstånd. I det ögonblick då ett av dessa tillstånd är ockuperat av en elektron, måste de andra elektronerna placeras i ett annat tillstånd.
Artikelindex
- 1. Introduktion
- 2 Plats i det periodiska elementet
- 3 Elektronens placering i orbitalerna
- 4 Speciella elektroniska konfigurationer
- 5 Referenser
Introduktion
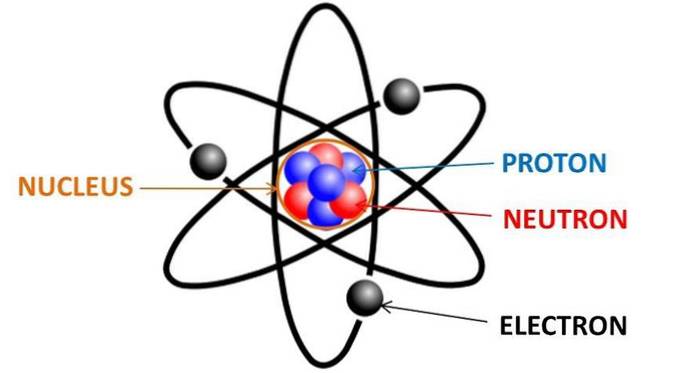
Varje kemiskt element i det periodiska systemet består av atomer, som i sin tur består av neutroner, protoner och elektroner. Elektroner är negativt laddade partiklar som finns runt kärnan i vilken atom som helst, fördelade i elektronernas orbitaler.
Elektronorbitaler är volymen på rymden där en elektron har 95% chans att mötas. Det finns olika typer av orbitaler, med olika former. Maximalt två elektroner kan placeras i varje omlopp. Den första banan i en atom är där det är största sannolikheten att hitta elektroner.
Orbitalerna betecknas med bokstäverna s, p, d och f, det vill säga Sharp, Principle, Diffuse och Fundamental, och de kombineras när atomer går ihop för att bilda en större molekyl. I varje lager av atomen finns dessa kombinationer av orbitaler.
Till exempel, i skikt 1 av atomen finns S-orbitalerna, i skikt 2 finns S- och P-orbitaler, inom skikt 3 av atomen finns S-, P- och D-orbitaler och slutligen i lager 4 av atomen finns S-, P-, D- och F-orbitalerna.
Också i orbitalerna hittar vi olika undernivåer, som i sin tur kan lagra fler elektroner. Orbitaler vid olika energinivåer liknar varandra men upptar olika områden i rymden..
Den första orbitalen och den andra orbitalen har samma egenskaper som en S-orbital, de har radiella noder, de har större sannolikhet för sfärisk volym och de kan bara hålla två elektroner. De ligger dock på olika energinivåer och upptar därmed olika utrymmen runt kärnan..
Plats på det periodiska elementet
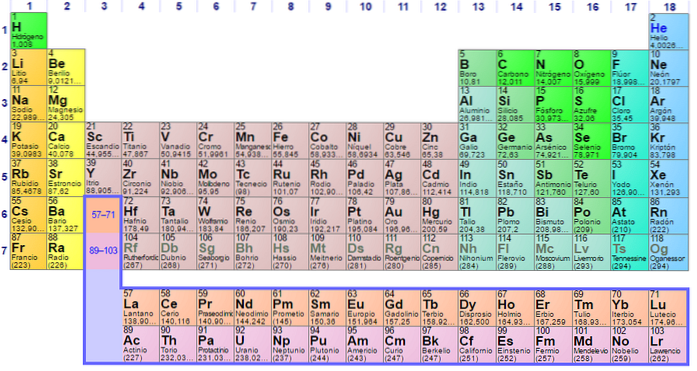
Var och en av de elektroniska konfigurationerna av elementen är unik, varför de bestämmer deras position i det periodiska elementet. Denna position definieras av perioden för varje element och dess atomnummer av antalet elektroner som elementets atom har..
Således är det viktigt att använda det periodiska systemet för att bestämma konfigurationen av elektroner i atomer. Elementen är indelade i grupper enligt deras elektroniska konfigurationer enligt följande:
Varje omlopp representeras i specifika block inom det periodiska elementet. Till exempel är blocket av S-orbitaler regionen av alkalimetallerna, den första gruppen i tabellen och där sex element finns Litium (Li), Rubidium (Rb), Kalium (K), Sodium (Na), Francium ( Fr) och Cesium (Cs) och även väte (H), som inte är en metall utan en gas.
Denna grupp av element har en elektron som lätt går förlorad för att bilda en positivt laddad jon. De är de mest aktiva metallerna och de mest reaktiva.
Väte är i detta fall en gas, men det ligger inom grupp 1 i det periodiska elementet eftersom det också bara har en elektron. Väte kan bilda joner med en enda positiv laddning, men att dra ut sin enda elektron kräver mycket mer energi än att ta bort elektroner från andra alkalimetaller. Vid bildning av föreningar genererar vanligtvis väte kovalenta bindningar.
Men under extremt höga tryck blir väte metalliskt och beter sig som resten av elementen i sin grupp. Detta sker till exempel inuti kärnan på planeten Jupiter.
Grupp 2 motsvarar jordalkalimetallerna, eftersom deras oxider har alkaliska egenskaper. Bland elementen i denna grupp hittar vi magnesium (Mg) och kalcium (Ca). Deras orbitaler hör också till S-nivån.
Övergångsmetallerna, som motsvarar grupperna 3 till 12 i det periodiska systemet, har orbitaler av D-typ..
Elementen som går från grupp 13 till 18 i tabellen motsvarar orbitaler P. Och slutligen har elementen som kallas lantanider och aktinider orbitaler som heter F.
Elektronplats i orbitaler
Elektroner finns i atomens orbitaler som ett sätt att sänka energi. Därför, om de försöker öka energin, kommer elektronerna att fylla de viktigaste orbitalnivåerna och flytta bort från atomens kärna..
Det måste beaktas att elektroner har en inneboende egenskap som kallas spin. Detta är ett kvantbegrepp som bland annat bestämmer elektronens centrifugering i banan. Vad som är viktigt för att bestämma din position i energinivåerna.
Reglerna som bestämmer elektronernas position i atomens orbitaler är följande:
- Aufbaus princip: Elektroner kommer in i de lägsta energibanalerna först. Denna princip baseras på diagram över energinivåerna för vissa atomer.
- Pauli-uteslutningsprincip: En atombana kan beskriva minst två elektroner. Detta betyder att endast två elektroner med olika elektronsnurr kan uppta en atombana..
Detta innebär att en atombana är ett energitillstånd.
- Hunds regel: När elektronerna upptar orbitaler av samma energi kommer elektronerna in i de första tomma orbitalerna. Detta innebär att elektroner föredrar parallella snurr i separata banor för energinivåerna..
Elektronerna fyller alla orbitaler i undernivåerna innan de möter motsatta snurr.
Speciella elektroniska konfigurationer
Det finns också atomer med speciella fall av energinivåer. När två elektroner upptar samma omlopp, måste de inte bara ha olika snurr (som indikeras av Pauli-uteslutningsprincipen), men kopplingen av elektronerna höjer energin något..
I fallet med energinivåer minskar en halv full och en full full undernivå atomens energi. Detta leder till att atomen har större stabilitet.
Referenser
- Elektronkonfiguration. Återställd från Wikipedia.com.
- Introduktion till elektroniska konfigurationer. Återställd från chem.libretexts.org.
- Orbitaler och obligationer. Återställd från chem.fsu.edu.
- Periodiskt system, huvudgruppselement. Återställd från newworldencyclopedia.org.
- Elektrokonfigurationsprinciper. Återställd från sartep.com.
- Elektronisk konfiguration av element. Återställd från science.uwaterloo.ca.
- Elektron snurra. Återställd från hyperphysics.phy-astr.gsu.edu.



Ingen har kommenterat den här artikeln än.