
Chiralitet vad den består av och exempel
De chiralitet Det är en geometrisk egenskap där ett objekt kan ha två bilder: en höger och en vänster, som inte är utbytbara; det vill säga de är rumsligt olika, även om resten av deras egenskaper är identiska. Ett objekt som uppvisar kiralitet sägs helt enkelt vara "kiralt".
Höger och vänster händer är kirala: den ena är reflektion (spegelbild) av den andra, men de är inte desamma, eftersom tummarna inte sammanfaller när de placeras ovanpå varandra.
Mer än en spegel, för att veta om ett objekt är kiralt, måste följande fråga ställas: har det "versioner" för både vänster och höger sida?
Till exempel är ett vänsterhänt skrivbord och en högerhänt ett kiralt objekt; två fordon av samma modell men med ratten till vänster eller höger; ett par skor samt fötter; spiraltrappor i vänster riktning och i rätt riktning etc..
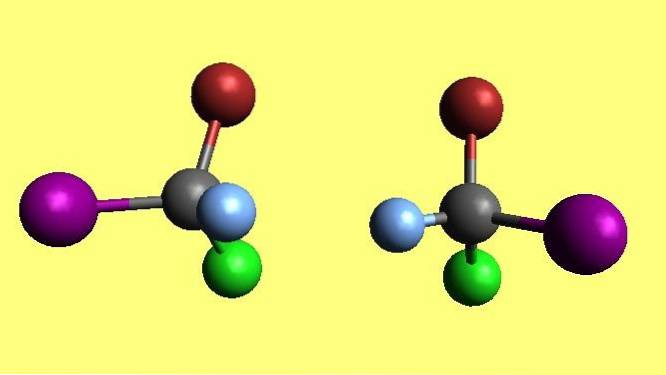
Och inom kemi är molekyler inget undantag: de kan också vara kirala. Bilden visar ett par molekyler med tetrahedral geometri. Även om den till vänster vänds och de blå och lila sfärerna görs vidrör, kommer de bruna och gröna sfärerna att "se" ut ur planet..
Artikelindex
- 1 Vad är kiralitet?
- 2 Exempel på kiralitet
- 2.1 Axiell
- 2.2 Planar
- 2.3 Andra
- 3 Referenser
Vad är kiralitet?
Med molekyler är det inte så enkelt att definiera vilken som är vänster eller höger "version" bara genom att titta på dem. För detta tillgriper organiska kemister Cahn-Ingold-Prelog (R) eller (S) -konfigurationerna eller i den optiska egenskapen hos dessa kirala substanser för att rotera polariserat ljus (vilket också är ett kiralt element)..
Det är dock inte svårt att avgöra om en molekyl eller förening är kiral bara genom att titta på dess struktur. Vad är det slående med molekylparet i den övre bilden??
Den har fyra olika substituenter, var och en med sin egen karaktäristiska färg, och geometrin runt den centrala atomen är tetraedrisk..
Om det i en struktur finns en atom med fyra olika substituenter kan det anges (i de flesta fall) att molekylen är kiral.
Sedan sägs det att i strukturen finns ett centrum för kiralitet eller stereogent centrum. Där det finns en kommer det att finnas ett par stereoisomerer som kallas enantiomerer.
De två molekylerna i bilden är enantiomerer. Ju större antal kirala centra som en förening har, desto större är dess rumsliga mångfald..
Den centrala atomen är i allmänhet en kolatom i alla biomolekyler och föreningar med farmakologisk aktivitet; men det kan också vara en av fosfor, kväve eller en metall.
Exempel på kiralitet
Centret för kiralitet är kanske ett av de viktigaste elementen för att avgöra om en förening är kiral eller inte..
Det finns dock andra faktorer som kan gå obemärkt förbi, men i 3D-modeller avslöjar de en spegelbild som inte kan läggas över..
För dessa strukturer sägs det att de istället för centrum har andra element av kiralitet. Med detta i åtanke är närvaron av ett asymmetriskt centrum med fyra substituenter inte längre tillräckligt, men resten av strukturen måste också analyseras noggrant; och därmed kunna skilja en stereoisomer från en annan.
Axial

Föreningar som visas ovan kan verka platt för blotta ögat, men de är det verkligen inte. Till vänster är den allmänna strukturen för en allen, där R betecknar de fyra olika substituenterna; och på höger sida den allmänna strukturen för en bifenylförening.
Det extrema där R möts3 och R4 kan visualiseras som en "fen" vinkelrätt mot planet där R ligger1 och Rtvå.
Om en observatör analyserar sådana molekyler genom att placera ögat framför det första kolet bundet till R1 och Rtvå (för alene), kommer du att se R1 och Rtvå till vänster och höger sida och till R4 och R3 upp och ner.
Om R3 och R4 förblir fasta men ändras R1 till höger och Rtvå till vänster finns det en annan "rumslig version".
Det är här som observatören sedan kan dra slutsatsen att han hittade en chiralitetsaxel för allen; detsamma händer med bifenyl, men med de aromatiska ringarna som är involverade i synen.
Ringskruvar eller Helicity
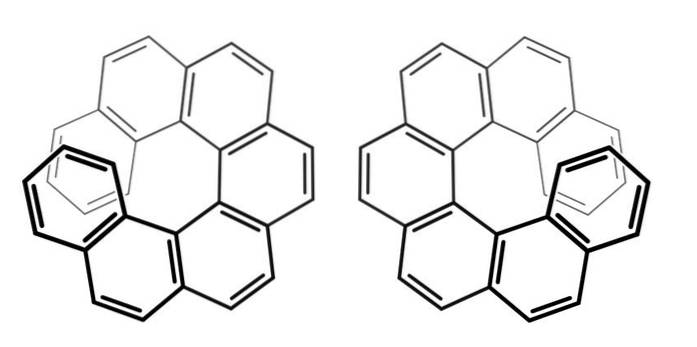
Observera att i det föregående exemplet låg chiralitetsaxeln i C = C = C-skelettet, för allen och i Ar-Ar-bindningen för bifenyl.
För föreningarna ovan kallade heptahelcenes (eftersom de har sju ringar), vad är deras axel för chiralitet? Svaret ges i samma bild ovan: Z-axeln, propellerns.
För att urskilja en enantiomer från en annan måste du titta på dessa molekyler ovanifrån (helst).
På detta sätt kan det beskrivas att en heptahelicen roterar medurs (bildens vänstra sida) eller moturs (bildens högra sida)..
Planar
Anta att du inte längre har en helikopter, utan en molekyl med icke-plana ringar; det vill säga den ena ligger ovanför eller under den andra (eller de är inte i samma plan).
Här vilar den kirala karaktären inte så mycket på ringen utan på dess substituenter; det är de som definierar var och en av de två enantiomererna.

Till exempel i ferrocen i den övre bilden ändras inte ringarna som "smälter" Fe-atomen; men ringens rumsliga orientering med kväveatomen och gruppen -N (CH3)två.
I bilden visas gruppen -N (CH3)två pekar åt vänster, men i sin enantiomer pekar den åt höger.
Andra
För makromolekyler eller de med enstaka strukturer börjar bilden förenklas. Varför? Eftersom det från deras 3D-modeller är möjligt att se från ett fågelperspektiv om de är kirala eller inte, som händer med objekten i de första exemplen..
Till exempel kan ett kolnanorör visa mönster för svängar åt vänster, och därför är det kiralt om det finns en identisk men med svängar åt höger..
Detsamma inträffar med andra strukturer där, trots att de inte har centrum för kiralitet, kan det rumsliga arrangemanget av alla deras atomer ha kirala former..
Vi talar då om en inneboende kiralitet, som inte beror på en atom utan på hela uppsättningen..
Ett kemiskt kraftfullt sätt att skilja den "vänstra bilden" från den högra är genom en stereoselektiv reaktion; det vill säga en där den bara kan förekomma med en enantiomer, medan med den andra nr.
Referenser
- Carey F. (2008). Organisk kemi. (Sjätte upplagan). Mc Graw Hill.
- Wikipedia. (2018). Kiralitet (kemi). Återställd från: en.wikipedia.org
- Advameg, Inc. (2018). Chiralitet. Återställd från: chemistryexplained.com
- Steven A. Hardinger och Harcourt Brace & Company. (2000). Stereokemi: Bestämning av molekylär kiralitet. Återställd från: chem.ucla.edu
- Harvard Universitet. (2018). Molekylär kiralitet. Återställd från: rowland.harvard.edu
- Oregon State University. (14 juli 2009). Chirality: Chiral & Achiral Objects. Återställd från: science.oregonstate.edu



Ingen har kommenterat den här artikeln än.