
Vändbara reaktionsegenskaper och exempel

A reversibel reaktion Det är en som någon gång under sin tid når ett tillstånd av jämvikt där koncentrationerna av reaktanterna och produkterna förblir konstanta; det vill säga, de varierar inte, eftersom hastigheten med vilken en konsumeras är densamma som den andra dyker upp. Det sägs också att ett sådant tillstånd motsvarar en dynamisk jämvikt.
Emellertid kunde jämvikt ses som en följd av reversibiliteten hos en kemisk reaktion; eftersom det i omvända reaktioner är omöjligt att upprätta någon jämvikt. För att detta ska hända måste produkterna kunna reagera med varandra under specifika förhållanden av tryck och temperatur, vilket får reaktanterna att återvända..
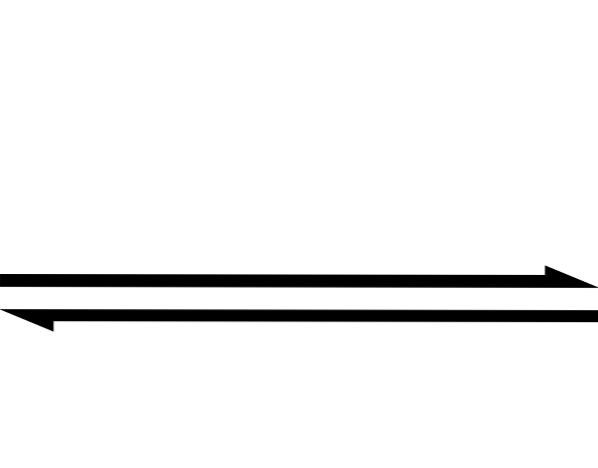
Ovanstående förenklas med hjälp av dubbelpilsymbolen (med två antiparallella huvuden). När vi ser det i en kemisk ekvation betyder det att reaktionen fortskrider i båda riktningarna: från vänster till höger (bildning av produkter) och från höger till vänster (bildning av reaktanter eller reaktanter).
Minoriteten av kemiska reaktioner är reversibla, och de finns mestadels i organiska och oorganiska synteser. I dessa är det extremt viktigt att veta vilka förhållanden som gynnar jämvikt för att kunna uppskatta de kvantiteter produkt som kan erhållas..
Artikelindex
- 1 Kännetecken för reversibla reaktioner
- 1.1 Allmän ekvation och jämvikt
- 1.2 Le Châtelier-principen
- 1.3 Kemiska förändringar
- 1.4 Kemiska arter
- 2 Exempel på reversibla reaktioner
- 2.1 Koboltkloridlösning
- 2.2 Vätejodid
- 2.3 Hydrolys
- 2.4 Kromat-dikromatlösning
- 2.5 Ammoniak
- 2.6 Förestring
- 3 Referenser
Kännetecken för reversibla reaktioner
Allmän ekvation och jämvikt
En reversibel reaktion har följande allmänna ekvation, med tanke på att det bara finns två reaktanter, A och B:
A + B ⇌ C + D
Den dubbla pilen indikerar att A och B reagerar för att producera C och D, men även C och D kan reagera med varandra för att regenerera reaktanterna; reaktionen i motsatt riktning, från höger till vänster, sker.
Den direkta reaktionen producerar produkter, medan den omvända, reaktiva. Om den ena är exoterm, måste den andra logiskt vara endoterm, och båda inträffar spontant; men inte nödvändigtvis i samma hastighet.
Exempelvis kan A och B vara mindre eller instabila än C och D; och därför konsumeras de snabbare än C och D kan regenerera dem.
Om produkterna C och D knappt reagerar med varandra kommer det att finnas en större ansamling av produkter än reaktanter. Detta innebär att när kemisk jämvikt uppnås kommer vi att ha högre koncentrationer av C och D än för A eller B, oavsett om deras koncentrationer inte varierar..
Jämvikten sägs då flyttas åt vänster, där det kommer att finnas fler produkter än reaktanter.
Le Châtelier-principen
En reversibel reaktion kännetecknas av att den sker i båda riktningarna i en kemisk ekvation, når en jämviktspunkt och svarar på yttre förändringar eller influenser enligt principen om le Châtelier.
Faktum är att tack vare denna princip kunde Berthollets observationer 1803, när han kände igen Na-kristaller, förklaras.tvåCO3 i en sandig sjö som ligger i Egypten. Den dubbla förskjutningsreaktionen skulle vara:
NatvåCO3(ac) + CaCltvå(ac) ⇌ NaCl (aq) + CaCO3(ac)
För att den omvända reaktionen ska ske måste det finnas ett överskott av NaCl, och således skulle jämvikten flyttas åt höger: mot bildandet av NaCltvåCO3.
Denna egenskap är av stor betydelse eftersom, på samma sätt, tryck eller temperaturer manipuleras för att gynna reaktionsriktningen som genereras av den intressanta arten..
Kemiska förändringar
Kemiska förändringar för reversibla reaktioner tenderar att vara mindre uppenbara än de som ses för irreversibla reaktioner. Det finns dock reaktioner, särskilt de som involverar metallkomplex, där vi ser temperaturberoende färgförändringar..
Kemiska arter
Vilken typ av förening som helst kan vara involverad i en reversibel reaktion. Man såg att två salter kan skapa en jämvikt, NatvåCO3 och CaCltvå. Detsamma händer mellan metallkomplex eller molekyler. Faktum är att mycket av de reversibla reaktionerna beror på molekyler med specifika bindningar som bryts och regenereras om och om igen..
Exempel på reversibla reaktioner
Koboltkloridlösning
En lösning av koboltklorid, CoCltvå, i vatten fläckar det rosa på grund av bildandet av en komplex vattenhaltig. När denna lösning värms upp ändras färgen till blå, vilket ger följande reversibla reaktion:
[Co (HtvåELLER)6]två+(ac) (rosa) + 4Cl-(ac) + Q ^ CoCl4två-(ac) (blå) + 6HtvåO (l)
Där Q levereras värme. Denna värme uttorkar komplexet, men när lösningen svalnar, eller om vatten tillsätts, återgår den till sin ursprungliga rosa färg..
Vätejodid
Följande reversibla reaktion är kanske den mest klassiska när man introducerar begreppet kemisk jämvikt:
Htvå(g) + Itvå(s) ⇌ 2HI (g)
Observera att reaktionen lyckas skapa en jämvikt även när joden är i fast tillstånd. Alla arter är molekylära: H-H, I-I och H-I.
Hydrolys
Hydrolyser är mycket representativa exempel på reversibla reaktioner. Bland de enklaste har vi den som genomgår en konjugerad syra eller bas. Hydrolys av ammoniumjonen, NH4+, och karbonatjonen, CO3två-, är följande:
NH4+(ac) + HtvåO (l) ⇌ NH3(g) + OH-
CO3två-(ac) + HtvåO (l) ⇌ HCO3-(ac) + OH-
Om vi lägger till en bas som bidrar med OH-joner- till mitten flyttar vi båda saldorna till vänster.
Kromat-dikromatlösning
Mycket lika som i det första exemplet genomgår en kromatlösning en färgförändring men på grund av variationer i temperatur men inte i pH. Den reversibla reaktionen är:
2CrO4två-(ac) (gul) + 2H3ELLER+(ac) ⇌ CrtvåELLER7två-(ac) (orange) + 3HtvåO (l)
Så om till en gul CrO-lösning4två- om den surgörs med någon syra blir dess färg omedelbart orange. Och om det sedan är alkaliserat eller rikligt med vatten tillsätts balansen till höger, den gula färgen dyker upp igen och Cr konsumeras.tvåELLER7två-.
Ammoniak
Syntesen av ammoniak, NH3, Det involverar en reversibel reaktion justerad så att det gasformiga kvävet, en mycket inert art, reagerar:
Ntvå(g) + 3Htvå(s) ⇌ 2NH3(g)
Förestring
Och slutligen nämns ett exempel på organisk kemi: förestring. Detta består i att erhålla en ester från en karboxylsyra och en alkohol i ett starkt surt medium. Den reversibla reaktionen är:
RCOOH + R'OH ⇌ RCOOR '+ HtvåELLER
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan). CENGAGE Learning.
- Walter J. Moore. (1963). Fysisk kemi. Inom kemisk kinetik. Fjärde upplagan, Longmans.
- Ira N. Levine. (2009). Principer för fysikalisk kemi. Sjätte upplagan, s. 479-540. Mc Graw Hill.
- Wikipedia. (2020). Vändbar reaktion. Återställd från: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (19 augusti 2019). Vändbar reaktionsdefinition och exempel. Återställd från: thoughtco.com
- Binod Shrestha. (05 juni 2019). Vändbara och irreversibla reaktioner. Kemi LibreTexts. Återställd från: chem.libretexts.org
- David Wood. (2020). Vändbara kemiska reaktioner: Definition och exempel. Studie. Återställd från: study.com


Ingen har kommenterat den här artikeln än.